
(7分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
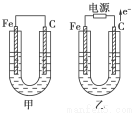
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_________________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式____________________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是2000 mL,则溶液混匀后的pH=________。
(1)①碳 铁 ②4OH--4e-===2H2O+O2↑ (2)①2Cl-+2H2O Cl2↑+H2↑+2OH- ②2H2O+O2+4e-===4OH- 氧化反应 ③12
Cl2↑+H2↑+2OH- ②2H2O+O2+4e-===4OH- 氧化反应 ③12
【解析】
试题分析:(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,答案为:碳;铁;
②乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,答案为:4OH--4e-=O2↑+2H2O;
(2)①电解NaCl溶液生成NaOH、H2和Cl2,离子反应为2Cl-+2H2O Cl2↑+H2↑+2OH-,答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,答案为:2Cl-+2H2O Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
②甲中碳为正极,氢氧根离子失去电子,电极反应为4OH--4e-=O2↑+2H2O,乙中碳为阳极,发生氧化反应;答案为:4OH--4e-=O2↑+2H2O;氧化反应;
③乙池转移0.02mole-,由2NaOH~2e-可知,n(NaOH)=0.02mol,c(NaOH)=0.02mo l /2L
=0.01mol/L,c(H+)=10-12mol/L所以pH=12。
考点:考查原电池和电解原理,分析清楚工作原理及发生的电极反应是解答的关键,注意电极的判断和电子守恒的应用


科目:高中化学 来源:2014-2015湖南省高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
实验室可用于检验淀粉的试剂是
A.NaOH溶液 B.盐酸 C.碘水 D.银氨溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省郴州市高一上学期期中考试化学试卷(解析版) 题型:选择题
除去下列物质中的杂质,所用试剂和方法不正确的是
物质 | 杂质 | 除杂质所用试剂和方法 | |
A | KCl溶液 | I2 | CCl4,萃取 |
B | KNO3 | K2SO4 | Ba(NO3)2溶液,过滤 |
C | Cu | CuO | 盐酸,过滤 |
D | CaCO3 | CaO | 盐酸,过滤 |
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省郴州市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体
A.①和② B.①和③ C.③和④ D.①和④
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省郴州市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列应用化学学科研究物质性质的基本方法或所得结论中,不正确的是
A.根据物质的元素组成,将纯净物分为单质和化合物
B.通过镁、锌、铁分别与稀盐酸反应的实验现象,比较不同金属的活泼性强弱
C.根据铁制品表面的锈可用稀盐酸溶解除去的事实,说明铁锈主要成分是酸性氧化物
D.打开盛装浓盐酸的试剂瓶塞,观察现象,了解盐酸的某些物理性质
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市四校高二12月联考化学试卷(解析版) 题型:选择题
下列推论正确的是
A.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+285.8 kJ·mol-1
B.对于反应2H2O2==2H2O+O2↑,升高温度能加快O2的生成速率
C.已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
D.在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl— [CuCl4]2—(绿)+4H2O,若向溶液中滴加足量AgNO3溶液,可使溶液呈现绿色
[CuCl4]2—(绿)+4H2O,若向溶液中滴加足量AgNO3溶液,可使溶液呈现绿色
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市四校高二12月联考化学试卷(解析版) 题型:选择题
下列有关物质的量浓度关系正确的是
A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.0.1 mol·L-1的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
D.pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:c(H+)+c(M+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省许昌市四校高一上学期第三次联考化学试卷(解析版) 题型:选择题
将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下气体0.224 L.则下列判断中正确的是
A.原混合物中n(Fe)∶n(Fe2O3)=2∶1
B.向溶液中滴入KSCN溶液,显红色
C.无法计算原混合物的质量a
D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列事实说明HNO2为弱电解质的是
①0.1 mol/L HNO2溶液的pH=2.1; ②常温下NaNO2溶液的pH>7 ; ③用HNO2溶液做导电实验时,灯泡很暗;④HNO2溶液和KCl溶液不发生反应 ⑤HNO2能与碳酸钠反应制CO2;⑥HNO2不稳定,易分解
A.①②③⑤ B.①②④⑤ C.①②⑥ D.①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com