
| A. | 在饱和硫酸铜溶液中放入胆矾晶体,几天后晶体外形发生改变且晶体质量变小 | |
| B. | 将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液和1mol?L-1CuCl2溶液中,铝片表面都观察不到明显的反应现象 | |
| C. | 可用紫外可见分光光度法来测定溶液中苯酚的含量 | |
| D. | 在比较乙醇和苯酚与钠反应的实验中,要把乙醇和苯酚配成同物质的量浓度的水溶液,再与相同大小的金属钠反应,来判断两者羟基上氢的活性大小 |
分析 A.饱和硫酸铜溶液,加入小块硫酸铜晶体,溶解和结晶是同时进行的,单位时间内溶解的质量等于结晶出来的固体的质量;
B.CuSO4和CuCl2溶液中铜离子水解,溶液显酸性,能先与氧化铝反应;
C.分光光度法是通过测定被测物质在特定波长处或一定波长范围内光的吸光度或发光强度,对该物质进行定性和定量分析的方法;
D.钠和水剧烈反应影响乙醇、苯酚和钠的反应.
解答 解:A.硫酸铜晶体和硫酸铜溶液存在着溶解平衡,即硫酸铜晶体不断溶解,溶液中的硫酸铜不断析出,由于在自然条件下结晶形成的晶体形状都是规则的,所以向饱和硫酸铜溶液中放入一小块硫酸铜晶体时硫酸铜晶体的形状会变得规则,而质量不发生变化,故A错误;
B.CuSO4和CuCl2溶液中铜离子水解,溶液显酸性,能先与氧化铝反应,去除氧化膜后,活泼的铝与酸反应会产生气体,同时铝也置换出铜,有红色物质析出,故B错误;
C.分光光度法是通过测定被测物质在特定波长处或一定波长范围内光的吸光度或发光强度,对该物质进行定性和定量分析的方法,可测定溶液中苯酚的含量,故C正确;
D.在比较乙醇和苯酚与钠反应的实验中,要把乙醇和苯酚配成同物质的量浓度的乙醚溶液,乙醚和钠不反应,不干扰乙醇、苯酚和钠的反应,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作、物质的性质、物质的分离以及鉴别等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
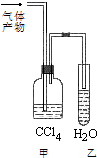 A、B、C、D、E、F 六种有机物.A能够在光照条件下与氯气发生取代反应,其二氯取代物有两种; B与溴的四氯化碳溶液可以发生加成反应,加成产物是D,且D只有一种同分异构体E;C在FeBr3 的作用下,可以与液溴发生取代反应,取代产物是F,F没有含苯环的同分异构体.根据以上事实,回答下列问题:
A、B、C、D、E、F 六种有机物.A能够在光照条件下与氯气发生取代反应,其二氯取代物有两种; B与溴的四氯化碳溶液可以发生加成反应,加成产物是D,且D只有一种同分异构体E;C在FeBr3 的作用下,可以与液溴发生取代反应,取代产物是F,F没有含苯环的同分异构体.根据以上事实,回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
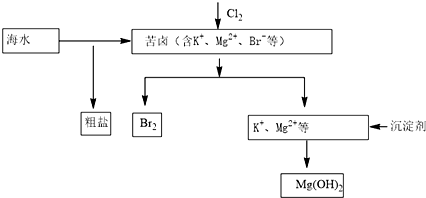
| A. | 工业生产中常选用NaOH作为沉淀剂 | |
| B. | 粗盐可采用溶解、过滤和重结晶等过程进一步提纯 | |
| C. | 向苦卤中通入Cl2是为了提取溴 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝片立即放出氢气的溶液中:C1-、K+、NH4+、NO3- | |
| B. | 滴加石蕊试液呈红色的溶液中:CO32-、K+、ClO-、OH- | |
| C. | pH=13的溶液中:HCO3-、Na+、NO3-、SO42 | |
| D. | 在pH=3的溶液中:NH4+、Ca2+、C1-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 观察要点 |
| A | 等浓度的醋酸与氢氧化钠溶液反应 | 恰好反应时的体积比 |
| B | 醋酸溶液中加入醋酸钠固体 | 溶液pH的变化 |
| C | 等体积等浓度的盐酸和醋酸分别和等量镁条反应 | 产生H2的起始速率 |
| D | 将pH=4的醋酸稀释成PH=6的溶液 | 加H2O的量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
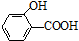 )存在分子内氢键,对羟基苯甲酸 (
)存在分子内氢键,对羟基苯甲酸 ( 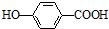 )存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )
)存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )| A. | 前者>后者 | B. | 前者<后者 | C. | 前者=后者 | D. | 无法估计 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com