
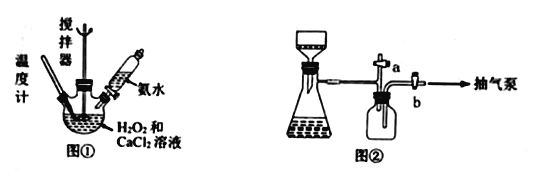
【题目】过氧化钙是一种在水产养殖中广泛使用的供氧剂。某实验研究小组用下图所示的装置制取过氧化钙并测定产品的含量。
有关过氧化钙的性质如下:
外观与性状 | 溶解性 | 稳定性 | |
过氧化钙(CaO2) | 白色结晶,无臭无味, 有潮解性 | 难溶于水,且不溶于 乙醇、乙醚 | 常温下稳定,加热至 315℃时开始分解 |
回答下列问题:
I.过氧化钙的制备
称取7.5gCaCl2·H2O,用5mL水溶解,加入25mL 30%的H2O2,边搅拌边滴加由5mL 浓NH3·H2O和20mL冷水配成的溶液,保持在0-5℃下充分反应半小时后抽滤,得到粗产品CaO2·8H2O。分别用少量冷水、乙醇洗涤该产品2~3次,在150℃下烘0.5-1h,冷却得到产品无水过氧化钙。
(1)图①盛装“CaCl2和H2O2混合液”的仪器名称______________________________。
(2)写出反应生成CaO2·8H2O的化学方程式___________________________________。
(3)抽滤后得到的晶体依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_________________________。
(4)用图②装置抽滤时,使用抽气泵抽真空前,应先关闭活塞____(填“a”或“b”)。
(5)反应温度以0~5℃为宜的原因____________________________。
II.产品中CaO2含量的测定
准确称取0.15g无水过氧化钙样品于锥形瓶中,加入50mL水和15mL2mol/LHCl,振荡使之溶解,立即用0.02mol/L的KMnO4溶液滴定至溶液呈微红色且半分钟内不褪色为止,重复实验3次,平均消耗20.00mL.KMnO4溶液。
(1)产品中CaO2的质量分数为_______________________________。
(2)若滴定后仰视读数,则测得样品中CaO2的含量___________(填“偏高”“偏低”或“不变”)
【答案】 三颈(烧)瓶 CaCl2+H2O2 +2NH3·H2O+6H2O =CaO2·8H2O↓+2NH4Cl 去除晶体表面的水 a 低于0℃,液体易冻结,使反应困难(或反应速率慢);温度高,氨水及过氧化氢易分解 48% 偏高
【解析】试题分析:I. (1)根据图①回答仪器名称;(2)CaCl2、H2O2 与浓NH3·H2O反应 生成CaO2·8H2O和2NH4Cl; (3)根据CaO2·8H2O难溶于乙醇,乙醇易挥发分析;(4)根据图②装置,活塞a与大气连通;(5)根据氨水、过氧化氢的性质分析;II. (1)根据关系式![]() 计算产品中CaO2的质量分数;(2)若滴定后仰视读数,消耗高锰酸钾溶液的体积偏大;
计算产品中CaO2的质量分数;(2)若滴定后仰视读数,消耗高锰酸钾溶液的体积偏大;
解析:I. (1)根据图①,盛装“CaCl2和H2O2混合液”的仪器名称是三颈(烧)瓶;(2)CaCl2、H2O2 与浓NH3·H2O反应 生成CaO2·8H2O和2NH4Cl,反应方程式是CaCl2+H2O2 +2NH3·H2O+6H2O =CaO2·8H2O↓+2NH4Cl;(3) CaO2·8H2O难溶于乙醇,乙醇易挥发,使用乙醇洗涤的目的是去除晶体表面的水;(4)图②装置,活塞a与大气连通,使用抽气泵抽真空前,应先关闭活塞a;(5) 低于0℃,液体易冻结,使反应困难(或反应速率慢);温度高,氨水及过氧化氢易分解,所以反应温度以0~5℃为宜;II. (1)设0.15g无水过氧化钙样品中含过氧化钙xg,
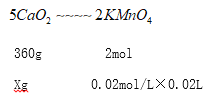
![]()
X=0.072g;产品中CaO2的质量分数![]() ;(2)若滴定后仰视读数,消耗高锰酸钾溶液的体积偏大,测得样品中CaO2的含量偏高。
;(2)若滴定后仰视读数,消耗高锰酸钾溶液的体积偏大,测得样品中CaO2的含量偏高。


科目:高中化学 来源: 题型:
【题目】近年来我国科学家在青蒿素应用领城取得重大进展,如利用下述反应过程可以制取治疗疟疾的首选药青蒿琥酯。下列有关说法正确的是
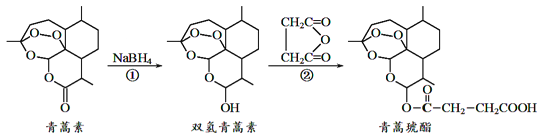
A. 青蒿素分子中所有碳原子在同一平面内
B. 反应①属于还原反应,反应②理论上原子利用率可达100%
C. 双氢青蒿素属于芳香族化合物
D. 青蒿琥酯可以发生水解、酯化以及加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的说法,正确的是( )
A. 1 mol FeI2 与足量的氯气反应时转移的电子数为3 NA
B. 12 mol/L的浓硫酸50 ml 与足量的Cu加热反应,得到SO2为0.3 mol
C. 配制一定物质的量浓度溶液时,溶液的体积与容量瓶的量程一致
D. 1 mol NaHSO4固体中含离子总数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
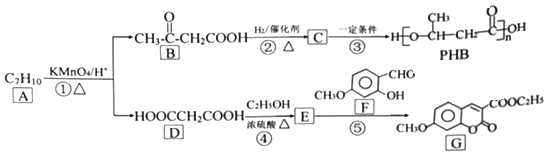
【题目】[化学选修5:有机化学基础]由化合物A 制备一种医药合成中间体G和可降解环保塑料PHB的合成路线如下:
己知: ![]() (-R1、-R2、-R3 均为烃基)
(-R1、-R2、-R3 均为烃基)
回答下列问题:
(1)A的结构简式____________________,G中含氧官能团的名称____________________。
(2)反应③和④的反应类型分别是_____________________、____________________________。
(3)F的分子式为________________________。
(4)E是二元酯,其名称是__________________,反应④的化学方程式____________________。(5) C 存在多种同分异构体,其中分别与足量的NaHCO3溶液和Na反应产生气体的物质的量相同的同分异构体的数目为______种。
(6)写出用B为起始原料制备高分子化合物![]() 的合成路线(其他试剂任选)。
的合成路线(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素代号 | A | B | D | E | X | Y | Z | W |
化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A. A的单质能将E单质从YE3的溶液中置换出来
B. A、Y、W的离子半径由大到小顺序是A>W>Y
C. X元素的单质不存在同素异形体
D. Z在DB2中燃烧生成两种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为________。
(2)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种):正四面体分子__________,三角锥形分子__________,V型分子__________。
(3)已知白磷(P4)的结构为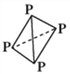 ,可知每个磷原子以___个共价键与另外的___磷原子结合成正四面体结构,它应该是________分子(填“极性”或“非极性”),在CS2中______(填“能”或“不能”)溶解,P原子的杂化方式为______________。
,可知每个磷原子以___个共价键与另外的___磷原子结合成正四面体结构,它应该是________分子(填“极性”或“非极性”),在CS2中______(填“能”或“不能”)溶解,P原子的杂化方式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶质为FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为血红色,则下列叙述不正确的是 ( )
A. 原溶液中的Br-不一定被氧化
B. 通入氯气之后原溶液中的Fe2+一定被氧化
C. 不能确定通入氯气之后的溶液中是否存在Fe2+
D. 若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知饱和碳酸的浓度约为0.033mol/L, Ka1=4.2×10-7、Ka2=5.61×10-11,其中的离子浓度大小顺序是
A. c(H+)>c(HCO3-)>c(OH-)>(CO32-)
B. c(H+)>c(HCO3-)>c(CO32-)>c(OH-)
C. c(HCO3-)>c(H+)>c(CO32-)>c(OH-)
D. c(H+)>c(CO32-)>c(HCO3-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com