
| A�� | һ������������ȼ�ϣ����������ԴΣ�� | |
| B�� | ����ȼ�յĻ�ѧ����ʽ����Ϊ4NH3+5O2$\frac{\underline{\;��ȼ\;}}{\;}$4NO+6H2O | |
| C�� | ���������״��棬��Ϊ����Һ�� | |
| D�� | �ڰ�ȼ�ϵ���У��������� |
���� A���ɻ�����ԴΣ���������ܽ����ԴΣ����
B�������������������ӦΪ������ˮ��
C������Һ����
D����ȼ���ڸ�����Ӧ��
��� �⣺A��������Ϊ��ʯȼ�ϵ����Ʒ���ɻ�����ԴΣ���������ܽ����ԴΣ������A����
B����ȼ�������£������������������ӦΪ������ˮ����B����
C������Һ�����״��棬��C��ȷ��
D����ȼ�ϵ���а����ڸ�����Ӧ����D����
��ѡC��
���� ���⿼��ʹ�û�ʯȼ�ϵ���������Դ�Ŀ������ѶȲ���ע���������������ԭ���ԭ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
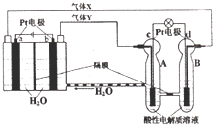
| A�� | ��0.1mol����ת��ʱ��a�缫����1.12LO2 | |
| B�� | c���Ϸ�����ԭ��Ӧ��B�е�H+����ͨ����Ĥ����A | |
| C�� | b���Ϸ����ĵ缫��Ӧ�ǣ�4H2O+4e-=2H2��+4OH- | |
| D�� | d�缫�Ϸ����ĵ缫��Ӧ�ǣ�O2+4H++4e-=2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢܢ� | B�� | �٢ڢݢ� | C�� | �ۢݢޢ� | D�� | �٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
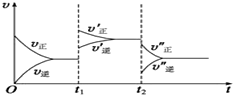 ���ڢ�N2��g��+3H2��g��??2NH3��g����H��0 ��2NH3��g��?N2��g��+3H2��g����H��0����v-tͼ��Ϊ��
���ڢ�N2��g��+3H2��g��??2NH3��g����H��0 ��2NH3��g��?N2��g��+3H2��g����H��0����v-tͼ��Ϊ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ����Ļ�ѧʽ | CH3COOH | HCN | H2S |
| ���볣����25�棩 | 1.8��10-5 | 4.9��10-10 | K1=1.3��10-7 K2=7.1��10-15 |
| A�� | �����ʵ���Ũ�ȵĸ���ҺPH��ϵΪ��PH��Na2S����PH��NaCN����PH��CH3COONa�� | |
| B�� | a mol/LHCN��Һ��b mol/LNaOH��Һ�������ϣ�������Һ��c��Na+����c��CN-������aһ������b | |
| C�� | NaHS��Na2S�Ļ����Һ�У�һ������c��Na+��+c��H+��=c��OH-��+c��HS-��+c��S2-�� | |
| D�� | ijŨ�ȵ�NaCN��Һ��pH=d����������ˮ�������c��H+��=10-dmol/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com