
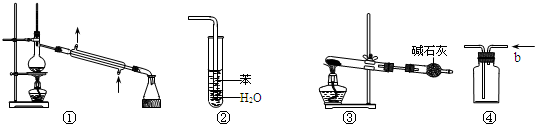
| A、装置①常用于分离互溶的液体混合物 |
| B、装置②可用于吸收HCl气体,并防止倒吸 |
| C、以NH4Cl为原料,装置③可用于实验室制备少量NH3 |
| D、装置④b口进气可收集H2、NH3等气体 |


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水结成冰 |
| B、石灰石煅烧成石灰 |
| C、铁矿石冶炼变为生铁 |
| D、氢气还原氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)2005年冬,广东省环保部门监测发现,广东北江韶关段出现了重金属镉超标现象,北江发生严重的水体污染事件,专家确定用1200吨的聚合铁(简称PFS,化学式为:[Fe2(OH)n(SO4)3-
(1)2005年冬,广东省环保部门监测发现,广东北江韶关段出现了重金属镉超标现象,北江发生严重的水体污染事件,专家确定用1200吨的聚合铁(简称PFS,化学式为:[Fe2(OH)n(SO4)3-| n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=13的氨水中含有OH-的数目为0.1NA |
| B、标准状况下,2.24 LNO2 与水反应生成NO3-的数目为0.1NA |
| C、1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA |
| D、4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 有关问题 |
| ①计算所需浓硫酸的体积 | 需取浓硫酸 |
| ②量取浓硫酸 | 需要用到的仪器是: |
| ③稀释浓硫酸 | 将浓硫酸 |
| ④转移 | 待溶液冷却至室温,将烧杯中溶液转移至 |
| ⑤定容 | 该步骤的正确操作是: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、30 | B、46 | C、50 | D、66 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com