
| A. | 11 | B. | 7 | C. | 5 | D. | 3 |
分析 柠檬水中的c(OH-)=10-11 mol/L,根据水的离子积求出其c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$,然后即可求出pH=-lgc(H+).
解答 解:柠檬水中的c(OH-)=10-11 mol/L,根据水的离子积可知其溶液中的c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,然后即可求出pH=-lgc(H+)=-lg10-3=3,故选D.
点评 本题考查了pH的简单计算,难度不大,应注意的是要求溶液的pH,必须最终求出溶液中氢离子浓度.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
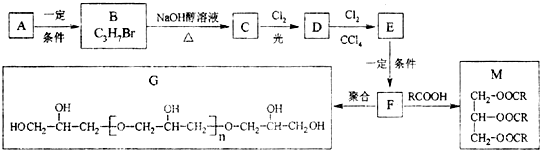
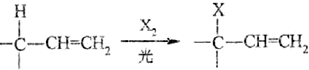
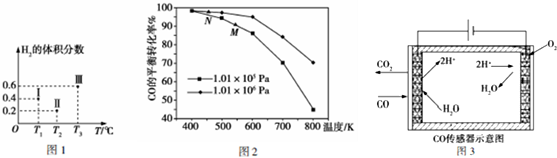
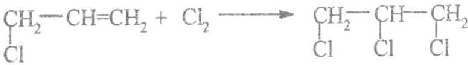 .
.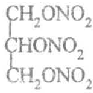 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠溶于水的反应:2Na+2H2O═2NaOH+H2↑ | |
| B. | 碳酸钠溶液和稀醋酸反应:CO2-3+2H+═H2O+CO2↑ | |
| C. | 向Ba(OH)2溶液中逐滴加入硫酸氢钠溶液至中性:2H++SO2-4+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 硫化亚铁中加入稀硝酸:FeS+2H+═Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
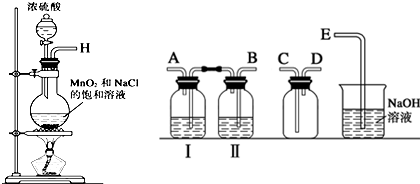
| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取少量上述漂白粉于试管中,先加入适量1mol•L-1盐酸溶解后,再把生成的气体通入新制澄清石灰水中. | 若澄清石灰水未见浑浊,则假设1成立; 若澄清石灰水变浑浊,则假设2或假设3成立. |
| 步骤2 | 已确定漂白粉变质,则另取少量上述漂白粉于试管中,先加入适量1mol•L-1 HCl溶液,再加入几滴品红溶液振荡. | 若品红溶液不褪色,则假设2成立; 若品红溶液褪色,则假设3成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B△H=+119kJ/mol,可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol | |
| D. | 在25℃、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则表示H2燃烧热的化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
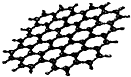 最近,科学家从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质.可以制成纳米材料.其结构如图所示:下列关于石墨烯的说法正确的是( )
最近,科学家从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质.可以制成纳米材料.其结构如图所示:下列关于石墨烯的说法正确的是( )| A. | 属于高分子化合物 | B. | 与金刚石互为同分异构体 | ||
| C. | 性质稳定不能与氧气等物质反应 | D. | 能导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com