
| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | HCl发生还原反应 | |
| C. | 氧化性KClO3>Cl2 | |
| D. | 被还原的物质是HCl |
分析 KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O中,Cl元素的化合价由+5价降低为0,Cl元素的化合价由-1价升高为0,以此来解答.
解答 解:A.氧化剂与还原剂的物质的量之比为1:5,故A错误;
B.Cl元素的化合价由+5价降低为0,则KClO3为氧化剂,发生还原反应,故B错误;
C.剂强于产物,KClO3是氧化剂,Cl2是氧化产物,所以氧化性KClO3>Cl2,故C正确;
D.Cl元素的化合价由+5价降低为0,则KClO3为氧化剂,是被还原的物质,而不是氯化氢,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意HCl的作用及氧化还原反应基本概念,题目难度不大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:解答题
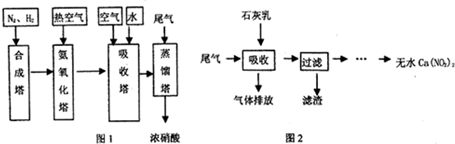
 CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1.
CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1. 6xH2O+(2x+3)N2.
6xH2O+(2x+3)N2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族的元素全部是金属元素 | |
| B. | 元素周期表有18个纵行,即18个族 | |
| C. | 短周期是第一、二、三、四周期 | |
| D. | 元素周期表有七个横行,也是七个周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径B>A>C>D | B. | 原子序数 a>b>c>d | ||
| C. | 离子半径C3->D->B+>A2+ | D. | 离子的还原性C3->D- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
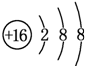 ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为 .
.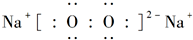 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在如图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,所含离子数目比为1:2;B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体.
在如图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,所含离子数目比为1:2;B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用加热法分离NH4Cl和I2 | |
| C. | 用无水乙醇提取碘水中的单质碘 | |
| D. | 用饱和Na2CO3溶液鉴别乙酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=5的NH4Cl溶液与pH=5的硫酸中,水电离的c(H+)相同 | |
| C. | pH=9的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

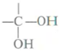 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$
 .
.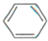 +
+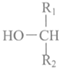 $\stackrel{酶}{→}$
$\stackrel{酶}{→}$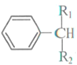 +H2O则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式
+H2O则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式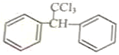 .
.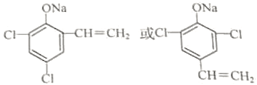 (任写一种)
(任写一种)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com