
| A.用烧碱溶液吸收Cl2:Cl2+2OH- =Cl-+ClO-+H2O |
| B.用饱和Na2CO3溶液转化锅垢中的CaSO4:CaSO4(s)+CO32- (aq)=CaCO3(s)+SO42-(aq) |
| C.实验室制备Fe(OH)3胶体:Fe3+ +3OH- =Fe(OH)3↓ |
| D.金属Na与水反应:Na +2H+ = H2↑+Na+ |
科目:高中化学 来源:不详 题型:实验题
| A.浓盐酸 | B.质量分数为70%的H2SO4 |
| C.稀硝酸 | D.质量分数为10%的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.大理石与盐酸反应:CO32-+ 2H+=H2O+CO2↑ |
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH- NH3↑+H2O NH3↑+H2O |
| C.将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
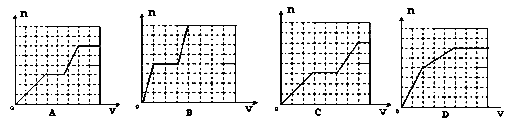
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应: |
| B.向一定体积一定物质的量浓度的氨水中滴加盐酸,所得溶液一定存在:c(H+)+c(NH4+)=c(Cl?)+c(OH?) |
| C.标准状况下4.48L二氧化碳气体通入到2L0.15mol?L?1的NaOH溶液中,离子浓度大小顺序为:c(Na+) > c(CO32?) > c(OH?) >c(HCO3?) > c(H+) |
| D.pH=8的0.1 mol·L-l CH3COONa溶液中由水电离出的c(OH?)=1.0×10-8mol?L?1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
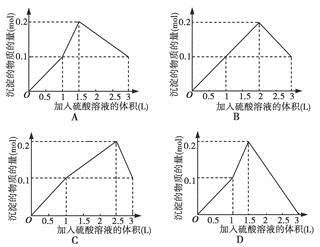
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O |
| B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
| C.硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+ |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.往FeI2溶液中通入过量氯气:Cl2+2Fe2+=2Cl-+2Fe3+ |
| B.将明矾溶于水中生成胶体:Al3++3H2O??Al(OH)3(胶体)+3H+ |
| C.大理石溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com