
【题目】实验室需要80mL 0.50mol/L稀硫酸,某同学用98%的浓硫酸(密度为1.84g/mL)进行配制.
(1)容量瓶上需标有以下五项中的________. (填字母)
A.温度 B.浓度 C.容量 D.压强 E.刻度线
(2)正确的操作顺序为_________(字母表示,每个字母只能用一次);
A.用少量水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡;
B.用量筒准确量取浓硫酸_______mL,沿器壁缓缓注入盛有少量水的烧杯中,用玻璃棒慢慢搅拌,使其混合均匀;
C.将已冷却的硫酸溶液沿玻璃棒缓缓注入____(填容量)容盘瓶中;
D.将容量瓶盖紧,颠倒摇匀;
E.改用____加水,使溶液凹液面恰好与刻度线相切;
F.继续往容量瓶内小心加水,直到液面至刻度线下________处.
(3)配制过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是(填序号)_____。
① 量取浓硫酸的量筒用蒸馏水洗涤2-3次,并把洗涤液转入容量瓶
② 用量筒最取浓硫酸时俯视刻度线
③ 容里瓶使用时未干燥.
④ 溶解后未经冷却就移液
⑤ 定容时仰视刻度线
⑥ 定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
【答案】 ACE BCAFED 2.7 100mL 胶头滴管 1-2cm ①④
【解析】(1)容量瓶是定容仪器,容量瓶上标有容量、温度及刻度线,故答案为ACE;
(2)配制一定物质的量浓度的溶液的配制步骤有:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以正确的操作顺序为:BCAFED;
其中:B.98%的浓硫酸(密度为1.84g/mL)的物质的量浓度为![]() =18.4mol/L,因实验室无80mL的容量瓶,则配制100mL0.50mol/L稀硫酸,需要用量筒量取浓硫酸的体积为
=18.4mol/L,因实验室无80mL的容量瓶,则配制100mL0.50mol/L稀硫酸,需要用量筒量取浓硫酸的体积为![]() =0.0027L=2.7mL;
=0.0027L=2.7mL;
C.选择配制100mL0.50mol/L稀硫酸,则需将已冷却的硫酸溶液沿玻璃棒缓缓注入100mL的容盘瓶中;
E.当液面离刻度线1-2cmcm时,应改用胶头滴管加水,使溶液凹液面恰好与刻度线相切;
F.定容时,需要继续往容量瓶内小心加水,直到液面至刻度线下1-2cm处,改用胶头滴管加水;
(3)①量取浓硫酸的量筒用蒸馏水洗涤2-3次,并把洗涤液转入容量瓶,会导致溶质的量偏多,则浓度偏高,故①正确;②用量筒最取浓硫酸时俯视刻度线,液面在刻度线的下方,浓硫酸的量偏少,配制的溶液浓度偏低,故②错误;③容量瓶使用时未干燥,对浓度无影响,故③错误;④溶解后未经冷却就移液,则冷却后溶液体积偏小,浓度偏高,故④正确;
⑤定容时仰视刻度线,液面在刻度线的上方,溶液体积偏大,浓度偏低,故⑤错误;
⑥定容后经振荡、摇匀、静置,发现液面低于刻度线是正常的,再加蒸馏水补至刻度线会导致浓度偏低,故⑥错误;故答案为①④。


科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
①标准状况下,1 L HCl和1 L H2O的物质的量相同;
②标准状况下,11.2 L H2和14 g N2所含原子数相同;
③28 g CO的体积约为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. 仅⑤⑥ B. 仅②⑤⑥
C. 仅②③⑤⑥ D. 仅①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室中利用下图装置(夹持装置略去)测定某铁硫化物(FexSy)的组成,并探究反应后D装置所得溶液中含硫化合物的组成。

(一)硫化物(FexSy)的组成
实验步骤:
步骤Ⅰ 如图连接装置,检査装置气密性,装入药品;
步骤Ⅱ 打开分液漏斗旋塞,缓缓滴入水,并点燃酒精喷灯;
步骤Ⅲ 当硬质玻璃管中固体质量不再改变时,停止加热,继续通入—段时间的O2
步骤Ⅳ 实验结束后,将D中所得溶液加水配制成250 mL溶液;
……
请回答:
⑴仪器a的作用为______________________。
(2)步骤Ⅲ中,停止加热后还需继续通入一段时间的O2,其目的为__________________。
(3)步骤IV中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有___________________。
(4)取25. 00 mL步骤IV中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66g。则FexSy的化学式为___________________。
(5)问题讨论:有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案________(填“是”或“否”)合理,原因为_______________________。
(二)探究反应后D装置所得溶液中含硫化合物的组成。
理论推测:溶液中除含有Na2SO4外,还可能含有Na2SO3。
实验探究:滴定法测定溶液中Na2SO3的含量。
可供选择的试剂:①0.10 mol L-1 KmnO4酸性溶液 ②30%H2O2
③0.10 mol L-1 KI淀粉溶液
(6)所选试剂为___________(填序号);所选试剂应装在_____________(填“酸式”或“碱式”)滴定管中。
⑦所利用的反应原理为__________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7是一种橙红色固体,可用于火柴制造、电镀、有机合成等方面。用某酸性废液(主要含Cr3+、还含有少量Fe2+、Fe3+和Al3+等)制备的流程如下:
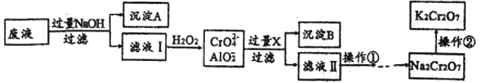
已知:H++CrO2-+H2O![]() Cr(OH)3
Cr(OH)3![]() Cr3++3OH-
Cr3++3OH-
回答下列问题:
(1)沉淀A的主要成分是_____________(填化学式,下同),流程中的X是__________。
(2)滤液Ⅰ中铬元素的存在形式主要是_____________(填离子符号)。
(3)操作是向滤液中加入稀硫酸调PH至一定范围。在酸性环境中CrO42-转化为Cr2O72-,溶液变为橙红色,该转化的离子方程式是__________;若PH高于此范围,造成的影响是__________。
(4)操作②是向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,说明相同温度下,在水中的溶解度:Na2Cr2O7______________ K2Cr2O7(填“>”、“<”或“=”)。
(5)PbO2可直接将溶液中的Cr3+氧化成Cr2O72-,该反应的离子方程式是__________。
(6)K2Cr2O7可用来测定溶液中Fe2+的含量,还原产物为Cr3+。若1L FeSO4溶液与100mL 0.1mol/L K2Cr2O7溶液恰好完全反应,则c(FeSO4)=___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
化合物F是一种重要的有机合成中间体。下面是以化合物A为原料合成化合物F的路线:

回答下列问题:
(1)化合物E中含氧官能团的名称是________________。
(2)以羟基为取代基,化合物A的化学名称是________________,A分子中最多有_______个原子共平面。
(3)D生成E的反应类型为_________________,由C生成D的化学方程式为_____________________。
(4)满足下列条件的E的芳香族同分异构体共有____________种(不含立体异构);
①能发生银镜反应和水解反应
②其水解产物之一能与FeCl3溶液发生显色反应
其中核磁共振氢谱显示为四组峰,且峰面积比为1∶2∶3∶6的一种同分异构体的结构简式为________________________。
(5)参照上述合成路线,以![]() 和CH2(COOH)2为原料(其他试剂任选),设计制备
和CH2(COOH)2为原料(其他试剂任选),设计制备![]() 的合成路线[已知:
的合成路线[已知:![]() ]:_________________________________________________________。
]:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 氯气和澄清石灰水反应:Cl2+2OH-=Cl-+ClO-+H2O
B. 碳酸氢钠溶液与氢氧化钠溶液反应:OH-+HCO3-=CO2+H2O
C. 向氯化铝溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓
D. 用大理石和稀醋酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如下图所示,下列说法错误的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如下图所示,下列说法错误的是

容器 | 起始物质的量 | ||
NO | CO | ||
Ⅰ | 1mol | 0.5mol | |
Ⅱ | 2mol | 1mol | |
A. 反应N2(g)+2CO2(g)![]() 2NO(g)+2CO(g)的ΔH<0,ΔS>0
2NO(g)+2CO(g)的ΔH<0,ΔS>0
B. P点的速率比M点慢
C. M、N两点容器内的压强: P(M) <2P(N)
D. N点的平衡常数为44.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
H、C、N、O、W、Fe、V都是生活与化学工业中常见元素,请回答下列问题:
⑴碳负离子CH3-的空间构型为_______;根据等电子原理,NO+的电子式为________。
⑵N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是________;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为______。

(3)钒可用于人工合成的二价钒固氮美酶(结构如图甲)。钒固氮酶中钒的配位原子有__________(填元素符号)。
(4)烟酰胺(结构如图乙)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有______,1 mol该分子中含σ键的数目为________________。
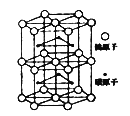
(5)下图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有______个,1个钨原子周围距离钨原子最近的碳原子有______个,假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为___________________。
(6)12 g石墨烯(结构如图丙)中含有的正六边形的物质的量为_____mol;请你预测硅是否容易形成类似石墨烯的结构,并说明理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)燃煤烟气脱硫常用如下方法。
①用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:2CO(g)+SO2(g)=S(g)+2CO2(g) △H1= + 8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为______________________。
②一氧化碳还原法:在绝热恒容的密闭容器中,反应2CO(g)+SO2(g)![]() S(s)+2CO2(g)达到平衡时,下列说法正确的是____(填序号)。
S(s)+2CO2(g)达到平衡时,下列说法正确的是____(填序号)。
a.容器内气体的压强保持不变 b.分离出S,正反应速率减小
若再充入一定量的CO2,反应的平衡常数不变
③用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。实验测得NH4HSO3溶液中![]() =15,则溶液的pH为________。 (已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=15,则溶液的pH为________。 (已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
(2)电解NO可以制备NH4NO3,其工作原理如下图所示,阳极的电极反应式为:____________,为使电解产物全部转化为NH4NO3,需补充物质A,A是___________ 。

(3)Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后首先析出的沉淀是________。当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-1),此时S2-的浓度为_________________________
(已知: Ksp(FeS)=6.3×10-18 ;Ksp(CuS)=6×10-36 ;Ksp(PbS)=2.4×10-28)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com