
分子式为C8H10的芳香烃的同分异构体的数目是( )
A.3 B.4 C.5 D.6
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,下列有关说法正确的是
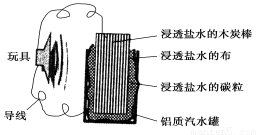
A.电池的能量转化率可达100%
B.铝罐是电池的负极
C.炭棒应与玩具电机的负极相连
D.电池工作一段时间后炭棒和碳粒的质量会减轻
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O O2+2H2O+4e-═4OH-下列说法错误的是
A.氢气在负极发生氧化反应 B.供电时的总反应为:2H2+O2═2H2O
C.产物为无污染的水,属于环境友好电池 D.燃料电池的能量转化率能达到100%
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:填空题
(15分)
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1541 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背了 ,B元素位于周期表五个区域中的 _______区。

②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②六氰合亚铁离子[Fe(CN)6]4—中不存在 。
A共价键 B非极性键 C配位键 D.σ键 E.π键
③写出一种与 CN—互为等电子体的单质分子式 。
(3)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
①确定该合金的化学式 。
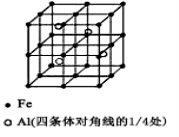
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

下列说法正确的是( )
A.固体混合物中一定含有Al,但质量不可确定 B.固体混合物中可能含有MgCl2和AlCl3
C.固体混合物中一定含有MgCl2和FeCl2 D.固体混合物中一定含有 (NH4)2SO4、MgCl2
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
下列各环境下的离子组合一定能大量共存的是( )
A.c(HCO3-)=1×10-1mol/L的溶液中Na+、AlO2-、CH3COO-、K+
B.由水电离出的c(H+)=1×10-14mol/L的溶液中CO32-、NH4+、SO42-、K+
C.甲基橙呈红色的溶液中Fe2+、Cl-、NO3-、Na+
D.能使pH试纸呈红色的溶液中Mg2+、Cl-、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:填空题
(7分)(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则

①此反应的化学方程式为________________;
②0~10s内,用Z表示的化学反应速率为________________;
③X的转化率为________________;
(2)恒温恒容时,某密闭容器中发生反应:C(s)+CO2(g)  2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
①C(s)的浓度不再改变 ②CO2的体积分数不再改变
③气体的质量不再改变 ④气体的密度不再改变
⑤单位时间内消耗1molCO2,同时生成2molCO
⑥n(CO2):n(CO)=1:2 ⑦v正(CO2)=2v逆(CO)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:选择题
下列说法正确的是
A.流水、风力是一次能源,电力、蒸汽是二次能源
B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
C.同周期元素形成的简单离子中,原子序数越大的离子半径越小
D.原子核外电子层数越多,原子半径一定越大
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:实验题
(15分)乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。
乙酰苯胺的制备原理为: 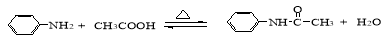
实验参数:
名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
苯 胺 | 93 | 无色油状液体, 具有还原性 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
实验装置:(见右图)
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离
实验步骤:
步聚1:在100ml圆底烧瓶中加入无水苯胺9.1mL,冰醋酸17.4mL,锌粉0.1g,安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,
调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步聚2: 在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步聚3: 将此粗乙酰苯胺进行重结晶,待结晶完全后抽滤,尽量压干滤饼。产品放在干净的表面皿中晾干,称重,计算产率。
请回答下列问题:
(1)实验中加入锌粉的目的是
(2)为何要控制分馏柱上端的温度在105?C左右
(3)通过什么现象可判断反应基本完成
(4)步聚1加热可用 (填“水浴”或“油浴”),步聚2中结晶时,若冷却后仍无晶体析出,可采用的方法是 。
(5)洗涤乙酰苯胺粗品最合适的试剂是 。
A. 用少量冷水洗 B. 用少量热水洗
C. 先用冷水洗,再用热水洗 D. 用酒精洗
(6)该实验最终得到纯品8.1克,则乙酰苯胺的产率是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com