Ⅰ.化学是一门以实验为基础的学科,下列实验操作描述中正确的是
①为使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒
②用托盘天平称取10.4g食盐时,将食盐放在右盘中的纸片上称量
③配制一定物质的量浓度的溶液时,容量瓶洗涤后未进行干燥
④以酚酞作指示剂,用标准浓度的盐酸滴定NaOH溶液,待溶液变成浅红色时即停止滴定
⑤测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数
Ⅱ.2011年3月12日,日本因大地震导致福岛核泄漏,主要泄漏物为碘131和绝137.在被辐射地区,每天服用一片碘片可以起到一定的预防作用.我国部分地区出现抢购加碘食盐现象.为此卫生部有关专家指出多吃碘盐起不到预防放射性碘辐射的作用,且我国碘盐丰富,不必抢购.碘片和碘盐相关信息:
碘片:主要成分是碘化钾,每片含100毫克的碘,防核辐射每天服一片.
碘盐:加碘食盐,主要成分是氯化钠、碘酸钾,每公斤食用盐中碘含量为20-30毫克.
KIO
3可用电解法制得:以石墨为阳极,不锈钢为阴极,在一定温度和电流下电解KI溶液,总反应方程式为:KI+3H
2O═KIO
3+3H
2↑.Na
2S
2O
3可与I
2反应:I
2+2S
2O
32-(无色)→2I
-+S
4O
62-(无色).
回答下列问题:
(1)碘化钾、碘酸钾中的碘是碘127,则碘127和碘131的原子结构中不相同的是
;以每公斤食用盐中碘含量为20毫克计,人每天吃
公斤盐才相当于服用一片碘片.说明靠吃碘盐来预防放射性碘
(填“有”、“无”)作用.
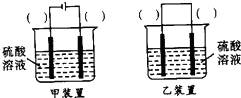
(2)电解法制KIO
3中,阳极的电极反应式为
;阴极附近pH值
(填“增大”、“减小”、“不变”).
(3)为防止不法商贩乘机销售假冒加碘食盐,有关部门加强了检测.下面是对某超市出售的加碘精制盐的检测过程:
①取该食盐样品100.0g加入适量的蒸馏水,振荡使固体完全溶解,然后加入用盐酸酸化的淀粉-KI溶液,结果溶液呈蓝色,有关反应的离子方程式为
;
②用0.010mol?L
-1的Na
2S
2O
3溶液滴定,当用去Na
2S
2O
3溶液12.00mL时蓝色刚好褪去,该加碘食盐中KIO
3的含量为
mg/kg.由此可判定该食盐为
(填“合格”或“不合格”)产品.



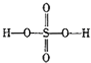 过硫酸:
过硫酸:
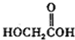 (b)
(b) 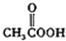 (c)H2O2(d)
(c)H2O2(d) 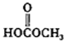 (e)
(e)  (f)
(f) 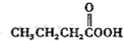 (g)O3(h)
(g)O3(h) 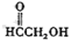
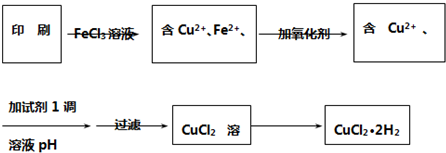
 以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示: