
| A. | 气态氢化物的稳定性:H2O>NH3>SiH4 | |
| B. | 氢元素与其他元素可形成共价化合物或离子化合物 | |
| C. |  如图所示实验可证明元素的非金属性:Cl>C>Si | |
| D. | 用中文“ ”(ào)命名的第118号元素在周期表中位于第七周期0族 ”(ào)命名的第118号元素在周期表中位于第七周期0族 |
分析 A.非金属性越强,对应氢化物越稳定;
B.H与F、Cl等形成共价化合物,与Na等形成离子化合物;
C.发生强酸制取弱酸的反应,且HCl不是最高价含氧酸;
D.目前周期表中112号元素位于第七周期的IIB族,118号元素的原子结构中有7个电子层、最外层电子数为8.
解答 解:A.非金属性O>N>Si,气态氢化物的稳定性:H2O>NH3>SiH4,故A正确;
B.H与F、Cl等形成共价化合物,与Na等形成离子化合物,则氢元素与其他元素可形成共价化合物或离子化合物,故B正确;
C.利用最高价含氧酸的酸性比较非金属性,HCl不是最高价含氧酸,则不能比较Cl、C的非金属性,故C错误;
D.目前周期表中112号元素位于第七周期的IIB族,118号元素的原子结构中有7个电子层、最外层电子数为8,则118号元素在周期表中位于第七周期0族,故D正确;
故选C.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,选项C为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 煤是由无机物和有机物组成的复杂混合物,其中含有苯、甲苯、二甲苯等有机物 | |
| B. | 石油的裂化是为了得到乙烯和丙烯 | |
| C. | 煤的干馏发生了化学变化 | |
| D. | 实验室石油分馏时,在蒸馏烧瓶中加入一些碎瓷片,防止暴沸;冷凝管上口进水,下口出水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 改变0.1mol•L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=$\frac{c(X)}{c({H}_{2}A)+c(H{A}^{-})+c({A}^{2-})}$].下列叙述错误的是( )
改变0.1mol•L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=$\frac{c(X)}{c({H}_{2}A)+c(H{A}^{-})+c({A}^{2-})}$].下列叙述错误的是( )| A. | pH=1.2时,c(H2A)=c(HA-) | B. | lg[K2(H2A)]=-4.2 | ||
| C. | PH=2.7时,c(HA-)>c(H2A)=c(A2-) | D. | pH=4.2时,c(HA-)=c(A2-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol 的11B中,含有0.6NA个中子 | |
| B. | pH=1的H3PO4溶液中,含有0.1NA个H+ | |
| C. | 2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 | |
| D. | 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P-Cl键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
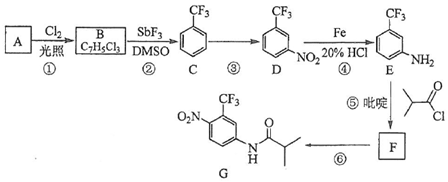
 .C的化学名称是三氟甲苯.
.C的化学名称是三氟甲苯.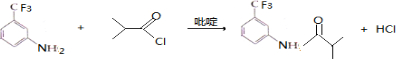 .吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.
.吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.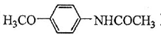 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(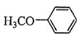 )制备4-甲氧基乙酰苯胺的合成路线
)制备4-甲氧基乙酰苯胺的合成路线 (其他试剂任选).
(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸是一种重要的有机酸,常温下是具有刺激性气味的液体 | |
| B. | 乙酸的分子式为C2H4O2,与甲酸(HCOOH)互为同系物 | |
| C. | 乙酸不能被酸性高锰酸钾稀溶液氧化 | |
| D. | 乙酸官能团的结构式为-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
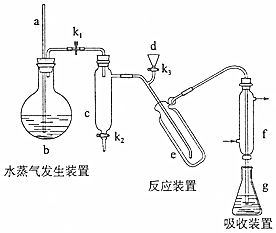
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 | 苯酚浓度小 |
| B | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
| C | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液;未出现银镜 | 蔗糖未水解 |
| D | 向某黄色溶液中加入淀粉 KI 溶液,溶液呈蓝色 | 溶液中含 Br2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
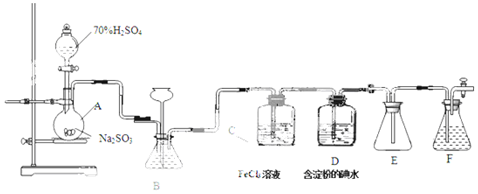
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com