
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 | |
| C. | 漂白粉有效成分是CaCl2和Ca(ClO)2,应密闭保存 | |
| D. | Cl2与水反应生成盐酸和次氯酸的离子方程式为:Cl2+H2O═2H++Cl-+ClO- |
分析 A.久置的氯水主要成分为HCl;
B.根据氯气难溶于饱和食盐水,HCl极易溶于水的性质分析;
C.漂白粉的有效成分是Ca(ClO)2;
D.次氯酸使弱酸,离子方程式中不能拆成离子;
解答 解:A.久置的氯水主要成分为HCl,只能使紫色石蕊试液变红,故A错误;
B.氯气难溶于饱和食盐水,HCl极易溶于水,将混合气体通过盛饱和食盐水的洗气瓶,可除去HCl,故B正确;
C.漂白粉的主要成分是CaCl2和Ca(ClO)2,漂白粉的有效成分是Ca(ClO)2,故C错误;
D.Cl2与水反应生成盐酸和次氯酸的离子方程式为:Cl2+H2O═H++Cl-+HClO-,故D错误;
故选B.
点评 本题考查氯气、氯水以及漂白粉的组成和性质,题目难度不大,注意次氯酸是弱酸,掌握基础是关键.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
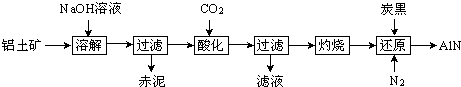
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
| 生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M+2Q | B. | M+4Q | C. | 2Q | D. | 2M+2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
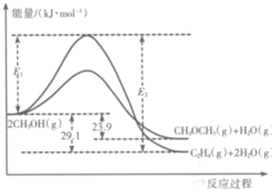
起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 在溶液中加稀盐酸,无现象,继续加入BaCl2溶液产生白色沉淀,证明原溶液有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C1>C2 | B. | 2C1=C2 | C. | 2C1<C2 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:Z<X | |
| C. | Y、Z的氧化物都有两性 | |
| D. | Y、W最高价氧化物对应水化物间可以相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
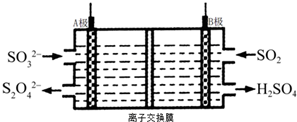
| A. | A电极接电源的正极 | |
| B. | A极区溶液的碱性逐渐增强 | |
| C. | 本装置中使用的是阴离子交换膜 | |
| D. | B极的电极反应式为SO2+2e-+2H2O═SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com