
分析 (1)在一般的化合物中,H元素为+1价、O元素为-2价,各元素化合价的代数和为0,据此判断P元素化合价;依据磷元素化合价变化判断,所含元素化合价升高的反应物为还原剂,所含元素化合价降低的反应物为氧化剂;
(2)反应中Ag+→Ag,化合价降1,反应中H3PO2→H3PO4,+1价的P化合价升高为磷酸分子中+5价,化合价升高4,依据得失电子守恒,原子个数守恒配平方程式;
(3)该反应中Ag元素化合价由+1价变为0价、P元素化合价由+1价变为+5价,转移电子数为4,据此解答;
(4)依据(3)可知生成4mol银,转移4mol电子;
(5)次磷酸(H3PO2)与D2O之间也能发生氢交换,但次磷酸钠(NaH2PO2)与D2O之间不能发生氢交换,说明次磷酸是一元酸,则次磷酸钠是正盐.
解答 解:(1)在一般的化合物中,H元素为+1价、O元素为-2价,各元素化合价的代数和为0,则P元素化合价为+1价;得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,反应中H3PO2→H3PO4,磷元素化合价升高,所以H3PO2做是还原剂;
故答案为:+1;还原剂;
(2)反应中Ag+→Ag,化合价降1,反应中H3PO2→H3PO4,+1价的P化合价升高为磷酸分子中+5价,化合价升高4,要使氧化剂得到电子总数等于还原剂失去电子总数,则Ag+系数为4,H3PO2系数为1,依据原子个数守恒,反应方程式:4Ag++H3PO2+2H2O═4Ag+H3PO4+4H+;
故答案为:4;1;2;4;1;4;
(3)该反应中Ag元素化合价由+1价变为0价,则氧化剂为Ag+,生成Ag为还原产物,P元素化合价由+1价变为+5价,则还原剂为H3PO2,生成H3PO4为氧化产物,转移电子数为4,用双线桥法在上式中标出电子转移的数目为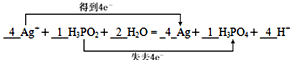 ,故答案为:
,故答案为: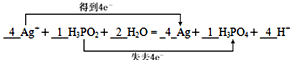 ;
;
(4)依据(3)可知生成4mol银,转移4mol电子,则若反应中生成5.4g Ag,物质的量为:$\frac{5.4g}{108g/mol}$=0.05mol,则转移电子个数为 0.05NA;
故答案为:0.05NA;
(5)次磷酸(H3PO2)与D2O之间也能发生氢交换,但次磷酸钠(NaH2PO2)与D2O之间不能发生氢交换,说明次磷酸是一元酸,则次磷酸钠是正盐,次磷酸钠还含有钠离子,所以还属于钠盐,
故选:AC.
点评 本题考查氧化还原反应有关知识,为高频考点,涉及氧化还原反应方程式配平、方程式的有关计算、弱电解质的电离等知识点,明确各个物理量关系、氧化还原反应方程式配平规则、弱电解质电离特点是解本题关键,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
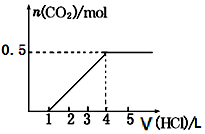 一定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
一定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )| A. | 通入的CO2气体为11.2 L | B. | A溶液中n(NaHCO3)=2n(Na2CO3) | ||
| C. | A溶液中既含NaOH,又含Na2CO3 | D. | A溶液中一定只有Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
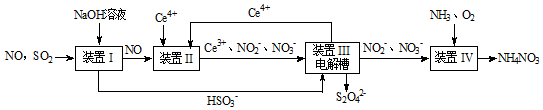
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
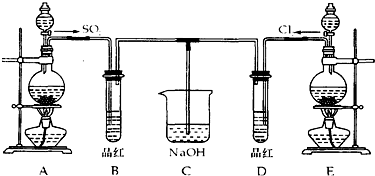
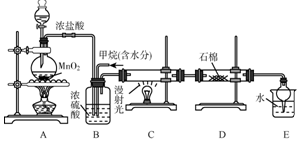 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 2.00 | 3.00 |
| t1 | 0.80 | |
| t2 | 1.80 |
| A. | 用H2表示反应在t1 min内的平均速率为v(H2)=$\frac{0.60}{t_1}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol | |
| C. | 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大 | |
| D. | 温度升至T2 K,上述反应的平衡常数为0.70,则正反应的△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com