
【题目】在下列反应中,水既作氧化剂又作还原剂的是( )
A. 2F2+2H2O===4HF+O2 B. 2Na+2H2O===2NaOH+H2↑
C. CaO+H2O===Ca(OH)2 D. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】CuCl为白色固体,微溶于水,不溶于乙醇和稀硫酸,在空气中迅速被氧化成绿色;见光则分解,变成褐色;已知CuCl+3Cl-=[CuCl4]3-。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
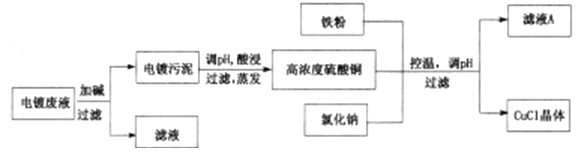
(1)图中的铁粉可以用二氧化硫气体代替,可以减少污染气体的排放,请写出用SO2代替铁粉进行反应的离子方程式:_____________。
(2)常温下形成电镀污泥时,溶液pH=9,已知Ksp[Fe(OH)3]=4×10-38,Ksp[Cu(OH)2]=2×10-20,此时溶液中c(Fe3+):c(Cu2+)=_______。
(3)析出CuCl晶体后,采用过滤的方法进行分离,再对晶体进行洗涤。下列关于洗涤的说法正确的是______(填序号)。
A.因为存在CuCl的沉淀溶解平衡,所以用饱和NaCl溶液洗涤可以降低CuCl的溶解度
B.尽量少用水洗涤,防止其溶解或水解生成CuOH
C.可以用乙醇洗涤使产品快速干燥
D.洗涤时在漏斗中充分搅拌,使杂质尽可能地溶解达到除去的目的
E.如果采用减压过滤,在洗涤时应该先打开阀门与空气相通,再关闭抽气泵,然后再向漏斗中加入洗涤液
(4)第三次过滤的滤液主要成分是_________。
(5)对污泥进行酸浸时的化学反应方程式为___________________。
(6)检验氧化亚铜晶体洗涤干净的操作是_______________。
(7)以粗铜为电极电解一定浓度的氯化钠溶液,控制一定的电压和电流,也可以制得氯化亚铜,写出电解时的阳极反应式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(b)由于其特殊的结构,一直受到结构和理论化学家的注意,根据其转化关系,下列说法正确的是
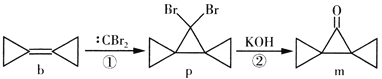
A. b的所有原子都在一个平面内
B. p在氢氧化钠的乙醇溶液中加热生成烯烃
C. m的同分异构体中属于芳香族化合物的共有5种
D. 反应①是加成反应,反应②是消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P-P:a kJ·mol-1、P—O:b kJ·mol-1、P===O:c kJ·mol-1、O===O:d kJ·mol-1。根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (6a+5d-4c-12b) kJ·mol-1
B. (4c+12b-6a-5d) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1
D. (4a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
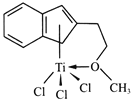
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
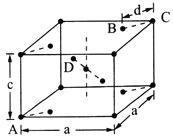
①A、B、C、D 4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下氯气和氢气共aL,在光照下充分进行反应,反应后的气体恰好能使bmol 氢氧化钠完全转化成盐,则a、b的关系不可能是下列的( )
A. b<![]() B. b<
B. b<![]() C. b>
C. b>![]() D. b>
D. b>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是

A. H2A在水中的电离方程式是:H2A===H++HA-、HA-![]() H++A2-
H++A2-
B. 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D. 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电离方程式。
(1)NaHCO3 _______________________________;
(2)H2SO4 _______________________________;
(3)NaOH _______________________________;
(4)NaHSO4 _______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com