
【题目】扁桃酸衍生物是重要的医药中间体,以A和B为原料合成扁桃酸衍生物F路线如图: 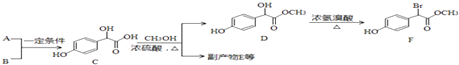
(1)A的分子式为C2H2O3 , 可发生银镜反应,且具有酸性,A所含官能团名称为: .
(2)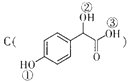 中①、②、③3个﹣OH的酸性有强到弱的顺序是: .
中①、②、③3个﹣OH的酸性有强到弱的顺序是: .
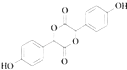
(3)E是由2分子C生成的含有3个六元环的化合物,写出E的结构简式:
(4)D→F的反应类型是 , 1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:mol.
(5)已知: ![]()
A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如图: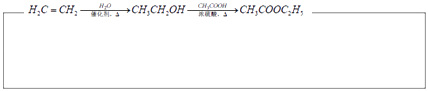
【答案】
(1)醛基和羧基
(2)③>①>②
(3)
(4)取代反应;3
(5)CH3COOH ![]() ClCH2COOH
ClCH2COOH ![]() HOCH2COONa
HOCH2COONa ![]() HOCH2COOH
HOCH2COOH ![]() OHC﹣COOH.
OHC﹣COOH.
【解析】解:A的分子式为C2H2O3 , 可发生银镜反应,且具有酸性,含有醛基和羧基,则A是OHC﹣COOH,根据C的结构可知B是 ![]() ,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为
,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为 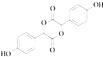 ;D发生取代反应生成F;(1)A为OHC﹣COOH,A所含官能团名称为:醛基和羧基,所以答案是:醛基和羧基;(2)羧基的酸性强于酚羟基,酚羟基的酸性强于醇羟基,故强弱顺序为:③>①>②,所以答案是:③>①>②;(3)E的结构简式:
;D发生取代反应生成F;(1)A为OHC﹣COOH,A所含官能团名称为:醛基和羧基,所以答案是:醛基和羧基;(2)羧基的酸性强于酚羟基,酚羟基的酸性强于醇羟基,故强弱顺序为:③>①>②,所以答案是:③>①>②;(3)E的结构简式: 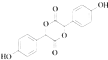 ,所以答案是:
,所以答案是:  ;(4)D→F的反应类型是取代反应,F中酚羟基、酯基水解生成的羧基、溴原子被取代生成的HBr都能和NaOH反应,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:3mol,所以答案是:取代反应;3;(5)由题目信息可知,乙酸与PCl3反应得到ClCH2COOH,在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2COONa,用盐酸酸化得到HOCH2COOH,最后在Cu作催化剂条件下发生催化氧化得到OHC﹣COOH,合成路线流程图为:CH3COOH
;(4)D→F的反应类型是取代反应,F中酚羟基、酯基水解生成的羧基、溴原子被取代生成的HBr都能和NaOH反应,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:3mol,所以答案是:取代反应;3;(5)由题目信息可知,乙酸与PCl3反应得到ClCH2COOH,在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2COONa,用盐酸酸化得到HOCH2COOH,最后在Cu作催化剂条件下发生催化氧化得到OHC﹣COOH,合成路线流程图为:CH3COOH ![]() ClCH2COOH
ClCH2COOH ![]() HOCH2COONa
HOCH2COONa ![]() HOCH2COOH
HOCH2COOH ![]() OHC﹣COOH,所以答案是:CH3COOH
OHC﹣COOH,所以答案是:CH3COOH ![]() ClCH2COOH
ClCH2COOH ![]() HOCH2COONa
HOCH2COONa ![]() HOCH2COOH
HOCH2COOH ![]() OHC﹣COOH.
OHC﹣COOH.


科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)下列实验操作或对实验事实的描述不正确的是(填序号).
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1molL﹣1NaOH溶液450mL和0.5molL﹣1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
①如图1所示的仪器中配制溶液肯定不需要的是(填序号);配制上述溶液还需用到的玻璃仪器是(填仪器名称).
②下列操作中,容量瓶所不具备的功能有(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为g.某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图2.由图中可以看出,烧杯的实际质量为g.
④根据计算得知,所需质量分数为98%、密度为1.84gcm﹣3的浓硫酸的体积为mL(计算结果保留一位小数).配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水是一项重要的化学工业,请完成下列计算:
(1)当电解产生0.2mol NaOH时,能收集到标准状况下的H2L.
(2)已知室温时饱和食盐水的溶质质量分数为0.265,取200g饱和食盐水进行电解,当NaCl反应了一半时停止电解,①求写出所得混合溶液中NaCl的质量,②求出所得混合溶液中NaOH的质量分数.(写出计算过程,保留3位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一澄清溶液其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、I﹣、NO3﹣、CO32﹣、SO42﹣中的几种,取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈现强酸性,排除的存在.
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4呈紫红色,生成该紫红色物质的离子方程式为 .
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,滴加过程中和滴加完毕后,均无沉淀产生,则可排除的存在.取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则证明有存在.生成该气体的离子方程式为 .
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成,证明存在,又排除存在.
(5)综上所述,该溶液中上述离子尚不能确定是否存在的 .
(6)若要确认(5)中相关的离子,确认的实验方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成导电高分子材料PPV的反应如图所示,下列说法正确的是( ) 
A.PPV是聚苯乙炔
B.该反应为缩聚反应
C.PPV与聚苯乙烯的最小结构单元组成相同
D.1 mol ![]() 最多可与2 mol H2发生反应
最多可与2 mol H2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列判断正确的是( )
A.1 molL﹣1 FeCl3溶液,含有Fe3+的数目为NA个
B.标准状况下,22.4L辛烷中分子数目为NA个
C.0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3 NA个
D.氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.00L 1mol/L氢氧化钠溶液中通入16.8L标准状况下的CO2气体,所得的溶液中含有的溶质是( )
A.Na2CO3
B.NaHCO3
C.Na2CO3和NaHCO3
D.NaOH、Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应广泛地存在于生产和生活之中.
(1)铜丝浸入AgNO3溶液后,表面会附有银白色物质,则还原性:银(填“大于”、“小于”或“等于”,下同)铜.
(2)为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3).碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4═3I2+3K2SO4+3H2O
①该反应中,氧化产物与还原产物的质量之比为 .
②当有1mol I2生成时,有mol还原剂被氧化.
(3)某一反应体系中有反应物和生成物共5种物质:H2S、HNO3、NO、H2O、X.
①已知H2S在反应中失去电子,则该反应的氧化剂是 .
②已知0.5mol H2S在反应中失去1mol电子生成X,则X的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的角度看,断开化学键要 , 形成化学键要 . 已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151k J、299k J.则由氢气和碘反应生成1mol HI需要(填“放出”或“吸收”) k J的热量.当反应物的总能量高于生成物总能量时,该反应为反应;当反应物的总能量低于生成物总能量时,该反应为反应.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com