
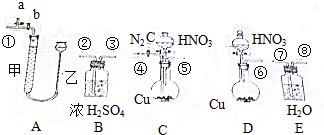
分析 (1)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,据此书写;
(2)足量铜与适量一定浓度的浓硝酸反应生成一氧化氮气体和二氧化氮气体,生成的混合气体经过水充分吸收后生成NO,可用量气装置测量体积;
(3)连接好装置并检查气密性后,应打开c,通入氮气,为保证NO和NO2完全被吸收以及被空气中氧气氧化;
(4)根据浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色,需要用水稀释;
(5)读数时,应使左右压强相等保证读数准确,可上下移动滴定管,使左右两边液面相平;
(6)E中发生3NO2+H2O=2HNO3+NO,根据方程式计算.
解答 解:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的离子方程式为Cu+4H++2NO3-═Cu2++2NO2↑+2H20,故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H20;
(2)为保证NO和NO2完全被吸收,NO易被氧化,应排除空气,实验前应通入足量的氮气,则应选择C装置,足量铜与适量一定浓度的浓硝酸反应生成一氧化氮气体和二氧化氮气体,生成的混合气体经过水充分吸收后生成NO,从⑦进气,可用量气装置测量体积,最后应连接A装置中的①,装置的连接顺序是④⑤⑦⑧①;
故答案为:④⑤⑦⑧①;
(3)NO易被氧化,应排除空气,实验前应通入足量的氮气,连接好装置并检查气密性后,应打开c,通入氮气,为保证NO和NO2完全被吸收以及防止一氧化氮被空气中氧气氧化;故答案为:检查气密性后;赶净装置中空气,防止生成的一氧化氮与氧气反应影响测定结果:
(4)将E中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验;因此,中和滴定前必须加水稀释,
故答案为:将E中的溶液加适量水稀释;
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面,应向下移动乙管,使甲、乙两管液面在同一水平面上,
故答案为:应向下移动乙管,使甲、乙两管液面在同一水平面上;
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L)气体为一氧化氮,物质的量=$\frac{VL}{22.4L/mol}$,E中硝酸的物质的量为amol,是二氧化氮和水反应生成的,反应的化学方程式为:3NO2+H2O=2HNO3+NO,所以生成nmol硝酸需要二氧化氮气体物质的量为1.5amol,生成一氧化氮气体物质的量为0.5amol;则铜与浓硝酸反应生成的气体中,二氧化氮物质的量为1.5amol;一氧化氮气体物质的量=$\frac{VL}{22.4L/mol}$mol-0.5amol;足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比,通过计算得到:
X=($\frac{VL}{22.4L/mol}$-0.5a):1.5a=(V-11.2a):33.6a,
故答案为:(V-11.2a):33.6a;
点评 本题考查了反应产物的成分测定,实验装置的分析判断,实验现象和数据的判断,气体体积的测定方法和原理应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
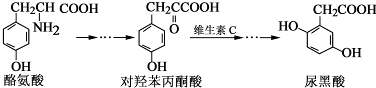
| A. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| B. | 1 mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 酪氨酸既能与盐酸反应,又能与氢氧化钠反应 | |
| D. | 1 mol尿黑酸与足量NaHCO3反应,最多消耗3 molNaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
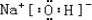 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质在液态时能导电 | B. | 该物质在水溶液中能导电 | ||
| C. | 该物质能溶于水 | D. | 该物质具有较高的熔、沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5Cl→CH2=CH2 | B. | 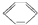 → → | ||
| C. | CH≡CH→CH2=CH2 | D. | CH3COOH→CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X:3s23P1 Y:3s23P5 | B. | X:2s22P3Y:2s22P4 | ||
| C. | X:3s23P2 Y:3s23P3 | D. | X:3s2 Y:2s22P3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛 | B. | 甲醛 | C. | 丙醛 | D. | 丁醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com