
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.
(1)已知25℃时:SO2(g)+2CO(g)═2C02(g)+ Sx(s)△H=a kJ•mol﹣1;
Sx(s)△H=a kJ•mol﹣1;
2COS(g)+SO2(g)═2CO2(g)+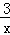 Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
(2)有人设想按如图甲所示装置用废气中的SO2生产硫酸.写出SO2电极的电极反应式 .
(3)提高反应2SO2(g)+O2⇌2SO3(g)△H<0中SO2的转化率是控制SO2排放的关键措施之一.某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为
50%,前5min内SO2的平均反应速率为 .
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是 (填序号).
a温度和容器体积不变,充入1.0molHe (g)
b温度和容器体积不变,充入2molSO2和lmolO2
c温度和容器体积不变,充入1.0molSO2
d在其他条件不变时,减小容器的容积
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)⇌2SO3(g)反应的影响,实验结果如
图乙所示.(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的
是 ,温度T1 T2(填“>”“<”或“一”).

考点: 热化学方程式;常见化学电源的种类及其工作原理;化学平衡的影响因素.
专题: 化学反应中的能量变化;化学平衡专题.
分析: (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)根据原电池反应是氧化还原反应,负极失电子发生氧化反应,正极上得到电子发生还原反应;
(3)①依据化学平衡三段式列式计算;
②改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大,依据化学平衡影响因素和平衡移动原理分析判断;
③依据图象分析,随压强量的增加,二氧化硫的转化率增大;依据平衡移动原理,反应是放热反应,温度越高,平衡逆向进行,三氧化硫含量减小.
解答: 解:(1)①SO2(g)+2CO(g)═2C02(g)+ Sx(s)△H=a kJ•mol﹣1;
Sx(s)△H=a kJ•mol﹣1;
②2COS(g)+SO2(g)═2CO2(g)+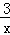 Sx(s)△H=b kJ•mol﹣1.
Sx(s)△H=b kJ•mol﹣1.
依据盖斯定律(①×2﹣②)÷2得到:CO(g)+ Sx(s)=COS(g)△H=
Sx(s)=COS(g)△H=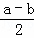 KJ/mol,
KJ/mol,
故答案为:CO(g)+ Sx(s)=COS(g)△H=
Sx(s)=COS(g)△H=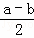 KJ/mol;
KJ/mol;
(2)据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸;电极反应为:SO2+2H2O﹣2e﹣=SO42﹣+4H+,
故答案为:SO2+2H2O﹣2e﹣=SO42﹣+4H+;
(3)①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,
2SO2(g)+O2⇌2SO3(g)△H<0
起始量(mol) 4.0 2.0 0
变化量(mol)4.0×50% 1.0 2.0
平衡量(mol) 2.0 1.0 2.0
前5min内SO2的平均反应速率=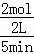 =0.2mol/L•min;
=0.2mol/L•min;
故答案为:0.2mol/L•min;
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是:
a、温度和容器体积不变,充入1.0molHe (g),总压增大,分压不变,平衡不动,故a不符合;
b、温度和容器体积不变,充入2molSO2和lmolO2,相当于增大压强,平衡正向进行,SO2的转化率及SO3的平衡浓度都比原来增大,故b符合;
c、温度和容器体积不变,充入1.0molSO2 ,平衡正向进行,三氧化硫浓度增大,二氧化硫转化率减小,故c不符合;
d、在其他条件不变时,减小容器的容积,压强增大,平衡正向进行,SO2的转化率及SO3的平衡浓度都比原来增大,故d符合;
故答案为:bd;
③依据图象分析,随压强量的增加,二氧化硫的转化率增大;依据平衡移动原理,反应是放热反应,温度越高,平衡逆向进行,三氧化硫含量减小,所以T1>T2,
故答案为:c;>.
点评: 本题考查了化学平衡的有关知识,化学反应进行的方向判断,转化率的计算、外界条件对化学平衡的影响,图象分析是关键,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
关于化学键的下列表述中,正确的是()
A. 共价化合物可能含有离子键
B. 离子化合物中可能含有共价键
C. 离子化合物中只含有离子键
D. 硫酸中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是( )
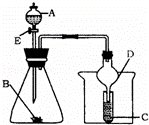
|
| A. | 若A为醋酸,B为贝壳(粉状),C为盛苯酚钠溶液,则C中溶液变浑浊 |
|
| B. | 若A为食盐水,B为电石,C中盛KMnO4溶液,则C中溶液褪色 |
|
| C. | 若A为浓氨水,B为生石灰,C中盛AgNO3溶液,则C中无现象 |
|
| D. | 实验中仪器D可起到防倒吸的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)⇌CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与 压强的关系如右下图所示.下列说法正确的是()
压强的关系如右下图所示.下列说法正确的是()
A.温度: T1>T2>T3
B.正反应速率: υ(b)>υ(d) υ(a)>υ(c)
C.平衡常数: K(a)>K(c) K(b)=K(d)
D.平均摩尔质量: M(b)>M(d) M(a)<M(c)
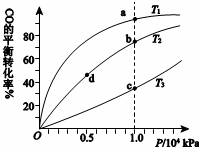
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
①将CO2通入BaCl2溶液中,始终无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42﹣
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后投入水中,两者放出的氢气质量相等
⑤将SO2通入溴水中,证明SO2具有漂白性
⑥在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色逐渐褪去,证明Na2CO3溶液中存在水解平衡
⑦因为SiO2能和CaCO3反应生成CO2,所以H2SiO3酸性强于H2CO3.
A. ②④⑥⑦ B. ①③④⑤ C. ③④⑤⑦ D. ②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是()
A. 26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA
B. 1mol甲基(﹣CH3)所含电子数为9NA
C. 标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数约为16NA
D. 标准状况下,1L庚烷所含有的分子数为NA/22.4
查看答案和解析>>
科目:高中化学 来源: 题型:
用一种试剂就能区分开苯酚、乙醇、NaOH溶液、AgNO3溶液、KSCN溶液这六种无色液体.它是()
A. 溴水 B. FeCl3溶液 C. 金属钠 D. CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列书写的离子方程式中,正确的是 ( )。
A.高锰酸钾溶液与乙二酸(草酸)反应:2MnO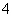 +5C2O
+5C2O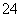 +16H+===2Mn2++10CO2↑+8H2O
+16H+===2Mn2++10CO2↑+8H2O
B.在NH4HSO4溶液中缓慢滴入含等物质的量的NaOH的溶液:NH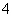 +OH-===NH3·H2O
+OH-===NH3·H2O
C.VO2+与酸性高锰酸钾溶液反应:5VO2++MnO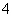 +H2O===5VO
+H2O===5VO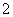 +Mn2++2H+
+Mn2++2H+
D.Fe2+被空气氧化:4Fe2++O2+2H2O===4Fe3++4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
小明因体内缺乏维生素A患了夜盲症,同学们七嘴八舌地给他提供补充维生素A的食谱。下列食品对补充维生素A没有明显作用的是 ( )。
A.鱼肝油 B.蛋黄
C.绿叶蔬菜 D.豆制品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com