
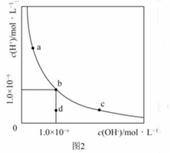
 一定温度下,水溶液中H+和OH-的浓度变化曲线如图2,下列说法正确的是( )
一定温度下,水溶液中H+和OH-的浓度变化曲线如图2,下列说法正确的是( )
A.升高温度,可能引起有c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α萜品醇G的路线之一如下:
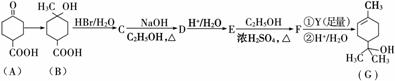
已知: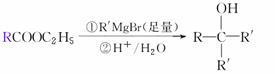 ′
′
请回答下列问题:
(1)A所含官能团的名称是__________________。
(2)A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:________________________________________________________________________。
(3)B的分子式为________;写出同时满足下列条件的B的链状同分异构体的结构简式:________________________________________________________________________。
①核磁共振氢谱有2个吸收峰
②能发生银镜反应
(4)B→C、E→F的反应类型分别为_________________、
__________________。
(5)C→D的化学方程式为_______________________。
(6)试剂Y的结构简式为_________________。
(7)通过常温下的反应,区别E、F和G的试剂是________和________。
(8)G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式: __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知一种c(H+)=1×10-3 mol·L-1的酸溶液和一种c(OH-)=1×10-3 mol·L-1的碱溶液等体积混合后,溶液呈酸性,其原因可能是( )
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
查看答案和解析>>
科目:高中化学 来源: 题型:
硅、硫、钠、铁、铝、铜等元素及其化合物在日常生活和生产中应用广泛,回答下列问题:
(1)Si元素在周期表中的位置是 , Na2S的电子式为 。
(2)H2S 、H2O 、SiO2、Na2O熔沸点由高到低的顺序为 。(用化学式表示)
(3)工业上常用氯化铁溶液腐蚀铜制电路板,反应的离子方程式是 。
要从上述腐蚀液中获得较纯的CuCl2溶液,需要将杂质 FeCl3和FeCl2除去,首先将Fe2+氧化成Fe3+,再向溶液中加入 (填化学式),最后过滤。
(4)在CuSO4溶液中通入过量的NH3,小心蒸发,最终得到[ Cu(NH3)4]SO4 晶体,晶体中含有的化学键除普通的共价键外,还含有 。
(5)将4.6g Na和8.1gAl组成的混合物投入到足量的水中,生成H2在标准状况下的体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g) COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
乙苯催化脱氢制苯乙烯反应:
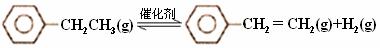
(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气 (原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
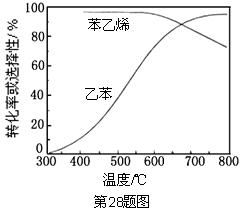
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。
②控制反应温度为600℃的理由是____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1 ②CO(g)+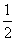
O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1 则③C(石墨,s)+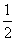 O2(g)===CO(g)的反应热是
O2(g)===CO(g)的反应热是
( )
A.-123 kJ·mol-1 B.-676.5 kJ·mol-1
C.-55.0 kJ·mol-1 D.-110.5 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com