
【题目】![]() 时,氯水中部分含氯的物种的分布分数
时,氯水中部分含氯的物种的分布分数![]() 平衡时某物种的浓度占各物种浓度之和的百分数
平衡时某物种的浓度占各物种浓度之和的百分数![]() 与pH的关系如图所示。下列叙述不正确的是( )
与pH的关系如图所示。下列叙述不正确的是( )
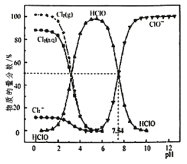
A.新制氯水中持续通入![]() ,pH不断变小,溶液颜色不断变浅
,pH不断变小,溶液颜色不断变浅
B.新制的![]() 的氯水中,
的氯水中,![]()
C.![]() 时,
时,![]() 的电离常数Ka的对数值为
的电离常数Ka的对数值为![]()
D.![]() 的氯水中加入NaOH溶液,主要发生的离子反应方程式为
的氯水中加入NaOH溶液,主要发生的离子反应方程式为![]()
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验的操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 实验结论 |
A | 向某溶液中加入硝酸酸化的BaCl2溶液 | 生成白色沉淀 | 原溶液中一定含有 |
B | 将 | 无白色沉淀生成 |
|
C | 向某溶液中加入少量双氧水后,再滴加几滴KSCN溶液 | 溶液变红色 | 原溶液中可能含有 |
D | 向某溶液中滴加稀盐酸 | 有气泡产生 | 原溶液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH>-57.4 kJ·mol-1
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)(红棕色)![]() N2O4 (g)(无色) ΔH<0
N2O4 (g)(无色) ΔH<0
C.甲烷的燃烧热为-890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1
D.硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+=S↓+SO2 ↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称: A ____________ B ____________ C ____________ D ____________。
(2)写出AB2的电子式为___________。
(3)用电子式表示化合物C2D的形成过程___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2![]() 3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
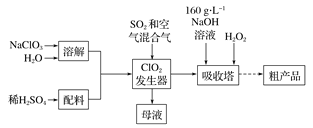
(1) ClO2发生器中的离子方程式为 ,发生器中鼓人空气的作用可能是__________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是_____________。
(3)从“母液”中可回收的主要物质是 。
(4)从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(5)为测定粗品中NaCl02的质量分数,做如下实验:
准确称取所得亚氯酸钠样品10.00 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴人适量的稀硫酸,充分反应(ClO2-+ 4I-+ 4H+= 2H2O+ 2I2+ Cl-)。将所得混合液配成250mL待测溶液,取25.00 mL待测液,用2.000 mol.L-lNa2S203标准液滴定(I2+2S2O32-= 2I-+S4O62-),测得消耗Na2SO3溶液平均值为16.40mL。该样品中NaClO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018 年 5 月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:

下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N2+6H++6e-= 2NH3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O2 流过电极的电子数为 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域.测定含![]() 浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是
浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是
①在中性溶液中,用溴将试样中![]() 氧化成
氧化成![]() ,将过量的溴除去
,将过量的溴除去
②再加入过量的碘化钾,在酸性条件下,使![]() 完全转化成
完全转化成![]()
③将②中生成的碘完全萃取后,用肼将其还原成![]() ,方程式为
,方程式为![]()
④将生成的![]() 萃取到水层后用
萃取到水层后用![]() 法处理
法处理
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化
⑥将⑤反应后的溶液以淀粉作指示剂,用![]() 标准溶液滴定,方程式为:
标准溶液滴定,方程式为:![]()
经过上述放大后,则溶液中![]() 浓度放大为原溶液中
浓度放大为原溶液中![]() 浓度的(设放大前后溶液体积相等)
浓度的(设放大前后溶液体积相等)
A.2倍B.4倍C.6倍D.36倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g)+ O2(g)2SO3(g) △H = - 196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A.前 5 min 的平均反应速率为v(SO2) = 0.08 mol/(L·min)
B.保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和 0.2 mol SO3(g)时, v正 > v逆
C.保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ的热量
D.相同条件下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为 40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其原子序数依次增大,且质子数均小于18。A元素原子的最外层只有1个电子,该元素阳离子与N3-核外电子排布相同;B元素原子核外各轨道上均无成单电子;C元素原子的价电子排布为ns2np2;D-的核外电子构型与Ar相同。
(1)写出A、C、D的元素符号:A________,C________,D________。
(2)写出B元素电子的电子排布式________;D元素电子的电子排布图______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com