
| A. | 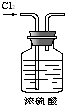 干燥Cl2 | B. | 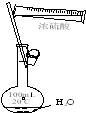 称量NaOH | C. | 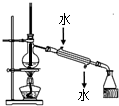 稀释浓硫酸 | D. | 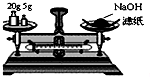 制取蒸馏水 |
分析 A.氯气可用浓硫酸干燥,气体从长导管进入;
B.氢氧化钠不能在容量瓶中溶解;
C.温度计位置以及水的进出方向错误;
D.称量时药品应放在左盘,氢氧化钠应放在小烧杯中称量.
解答 解:A.氯气可用浓硫酸干燥,气体从长导管进入,题给装置可用于干燥气体,故A正确;
B.容量瓶只能用于配制溶液,氢氧化钠不能在容量瓶中溶解,故B错误;
C.温度计水银球应在蒸馏烧瓶支管口附近,用于测量馏分的问题,冷凝水应从下端进、上端出,故C错误;
D.称量时药品应放在左盘,氢氧化钠具有腐蚀性,应放在小烧杯中称量,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及转移液体、溶液的配制以及分离与提纯等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2和Cl2使品红溶液褪色的原理相同 | |
| B. | 浓硫酸分别使胆矾变白、蔗糖变黑时,浓硫酸表现的性质相同 | |
| C. | 浓硝酸和浓硫酸露置在空气中,浓度都降低的原因相同 | |
| D. | 浓硫酸与稀硫酸都能与金属锌反应放出气体,两个反应的氧化产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不再发生变化 | |
| B. | v正(CO)=v正(H2O) | |
| C. | 生成n mol CO的同时,消耗n mol H2O | |
| D. | 1 mol H-H键断裂的同时,形成2 mol H-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

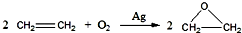
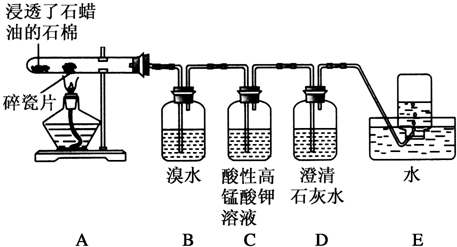
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质均是由分子构成,分子均是由原子构成的 | |
| B. | 某物质经测定,只含有一种组成元素,则该物质一定是单质 | |
| C. | 纯净的硫酸是纯净物,而不含杂质的盐酸是混合物 | |
| D. | 碱性氧化物均是金属氧化物,酸性氧化物均是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
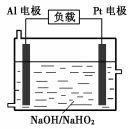 已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:
已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1的NaCl溶液 | B. | 75 mL 2 mol•L-1 NH4Cl溶液 | ||
| C. | 150 mL 3 mol•L-1的KCl溶液 | D. | 75 mL 3 mol•L-1的FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com