
![]()
(1)请完成该化学方程式并配平(将未知物化学式和计量数填入框内)。
(2)浓盐酸在反应中显示出来的性质是__________________________________________。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1 mol Cl2,则转移的电子的物质的量为__________mol。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的____________倍。
(1)2KClO3+4HCl(浓)====2KCl+2ClO2↑+1Cl2↑+2H2O
(2)② (3)0.2 (4)2.63
解析:(1)该问是本题的难点,学生经常出现的问题是:用化合价升降法配平化学方程式时,不明白ClO2和Cl2哪一个是氧化产物,哪一个是还原产物,因而无从下手。该反应是不同价态的同一元素之间的氧化还原反应,所得产物中该元素的化合价应介于反应物的高价和低价之间,且还原产物中该元素的化合价不低于氧化产物中该元素的化合价(不相交原则)。据此,可判断出氧化产物为Cl2,还原产物为ClO2,而KCl中的Cl-既不是氧化所得,也不是还原所得,而是直接来源于盐酸。再根据化学方程式两边元素守恒判断,缺项为H2O。最后,再用化合价升降法配平该化学方程式,得:
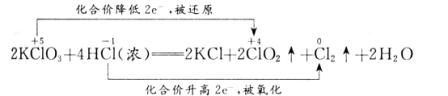
(2)由配平的化学方程式,可知参加反应的浓盐酸有一半被氧化,另一半起了酸的作用,故选②。
(3)由配平的化学方程式,可知每生成1 mol Cl2,将转移2 mol 电子,故产生0.1 mol Cl2转移电子的物质的量应为0.2 mol。
(4)此问的关键是要弄明白ClO2用作消毒剂时,其反应后的产物中氯元素的化合价。用Cl2消毒时也是利用其强氧化性,且其还原产物只能是Cl- (因为Cl2作氧化剂发生还原反应时,得电子,化合价降低,而比Cl2中氯元素化合价低的只有-1价的Cl-),故ClO2消毒时,其还原产物也应是稳定的Cl-。
ClO2![]() Cl- Cl2
Cl- Cl2![]() 2Cl-
2Cl-
67.5 g — 5 mol 71 g—2 mol
消毒效率是以单位质量得到的电子数表示的,故ClO2和Cl2的消毒效率可分别表示为:![]() 和
和![]() ,因
,因![]() ∶
∶![]() =2.63,故ClO2的消毒效率约为Cl2的2.63倍。
=2.63,故ClO2的消毒效率约为Cl2的2.63倍。


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com