
(6分)某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。当乙池中C极质量减轻10.8 g时,回答下列问题。
(1)写出A极的电极方程式: 。
(2)甲池中B电极理论上消耗O2的体积(标准状况下)为多少毫升?
(3)若丙池中溶液的体积为1000 mL,此时丙池中溶液的pH为多少?
解:(1)CH3OH-6e-+8OH-=CO32-+6H2O(2分)
(2)甲池中B电极理论上消耗O2的体积(标准状况下)为56ml。
(3)丙池中溶液的pH为1
串联装置,所以电子转移数目相等。
C极上的电极反应为:Ag - e- = Ag+
108 g 1 mol
10.8 g n(e-)
n(e-)=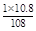 =0.1 mol (1分)
=0.1 mol (1分)
B电极上的电极反应为:O2 + 2H2O + 4e-=4OH-
1 4
n(O2) 0.1 mol
n(O2)=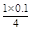 =0.025 mol
=0.025 mol
V(O2)=0.025 mol×22.4 L/mol=0.56 L=560 mL(1分)
(3)2Cu2++2H2O=2Cu+O2+4H+
4H+———— 4e-
4 mol 4 mol
n(H+) 0.1 mol
n(H+)=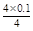 =0.1 mol(1分)
=0.1 mol(1分)
因1 L含n(H+)为0.1 mol,c(H+)=0.1 mol/L
则:pH=-lg c(H+)=-lg10-1=1(1分)
解析试题分析:(1)甲池能自发进行氧化还原反应为原电池,燃料电池中,燃料失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O。
(2)C极上的电极反应为:Ag-e-═Ag+,B电极上的电极反应为:O2+2H2O+4e-═4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.025mol,体积为0.025mol×22.4L/mol=0.056L=56mL。
(3)当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时丙池中E电极反应为2H2O-4e-═O2↑+4H+,所以生成的氢离子的物质的量0.1mol,则氢离子的浓度为0.1mol/L,所以PH=1。
考点:本题考查原电池和电解池原理。


科目:高中化学 来源: 题型:单选题
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是( )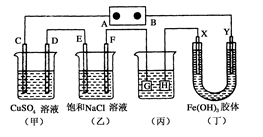
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2
C.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶体带正电荷
D.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将锌片和铜片用导线连接后平行放入稀硫酸中,发生原电池反应,下列叙述错误的是
| A.溶液的pH增大 |
| B.溶液中的Zn2+浓度增大 |
| C.溶液中的SO42— 浓度增大 |
| D.溶液的密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)氢氧化钾是重要的工业产品。请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是 。
(2)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因: 。
③除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(共10分)如图装置中,已知A、B两池溶液的体积均为200mL: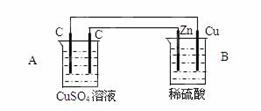
(1)判断装置的名称:A池为 ;
(2)A池中左边石墨棒为 极,
电极反应式为 ;
A池中总反应化学方程式为 ;
(3)若反应开始时,CuSO4溶液的浓度为1.0mol/L。工作一段时间后取出电极,测得导线上通过了0.04mole-。则反应后A池c(Cu2+)为 mol/L(体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)某研究小组对铁生锈进行研究:
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母)。
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为: ;
(3)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是( )
A. 锡 B. 铜 C. 锌
(4)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下: 
为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的_______极,发生的电极反应为_______________。
(2)该电池工作时(放电)反应的总化学方程式为___________________________________。
Ⅱ.铅蓄电池是化学电源,它工作时的电池反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O;
试回答:
(3)铅蓄电池正极的电极材料是_____________。
(4)工作时该铅蓄电池负极的电极反应是_____________________。
(5)铅蓄电池工作时,电解质溶液的密度_______(填“减小”“增大”或“不变”,下同),pH_______。
(6)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,当制得0.05molCl2时,在理论上电池内部消耗的H2SO4的物质的量是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)如下图装置所示,是用氢氧燃料电池B进行的某电解实验: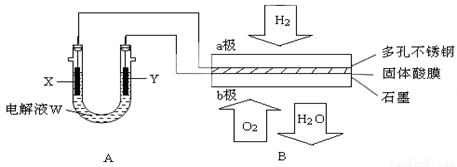
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:Li2NH+H2=LiNH2+LiH,则下列说法中正确的是________。
| A.Li2NH中N的化合价是-1价 | B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+ 和H+的离子半径相等 | D.此法储氢和钢瓶储氢的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在25 ℃时,用石墨电极电解2.0 L 2.5 mol·L-1CuSO4溶液,如有0.20 mol电子发生转移,请回答下列问题:
(1)阴极发生 反应,
电极反应式为 ;
(2)阳极发生 反应,
电极反应式为 ;
(3)电解后得到的铜的质量是 ,得到氧气的体积是 (标准状况),溶液的pH是 ;
(4)如果用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ,电解液的pH 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com