
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性溶液中分解产生S、SO2。
Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得,实验室模拟该工业过程的装置如图所示。
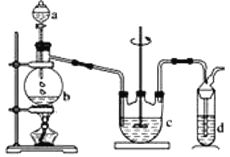
(1)b中反应的离子方程式为____,c中试剂为_____。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_____。
(3)实验中要控制SO2生成速率,可以采取的措施有______(写出两条)。
(4)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是____。
(5)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:_____。
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)
Fe(S2O3)33-(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O32-
装置 | 编号 | 试剂X | 实验现象 |
| ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色, 30s后溶液几乎变为无色 |
② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(6)根据实验①的现象,初步判断最终Fe3+被S2O32-还原为Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:_____。
(7)同浓度氧化性:Ag+ > Fe3+。实验②中Ag+未发生氧化还原反应的原因是____。
(8)进一步探究Ag+和S2O32-反应。
装置 | 编号 | 试剂X | 实验现象 |
| ③ | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:Ag2S2O3+___=Ag2S+___
(9)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和___有关(写出两条)。
【答案】SO32-+2H+=SO2↑+H2O或HSO3-+2H+=SO2↑+H2O 硫化钠和碳酸钠混合溶液 硫 控制反应温度、调节酸的滴加速度(或调节酸的浓度等) 若SO2过量,溶液显酸性,产物分解 取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质 生成紫色配合物的反应速率快,氧化还原反应速率慢;Fe3+与S2O32-氧化还原反应的程度大,Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色。 Ag+与S2O32-生成稳定的配合物,浓度降低,Ag+的氧化性和S2O32-的还原性减弱 H2O H2SO4 阳离子、用量等
Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色。 Ag+与S2O32-生成稳定的配合物,浓度降低,Ag+的氧化性和S2O32-的还原性减弱 H2O H2SO4 阳离子、用量等
【解析】
(1)第一个装置为二氧化硫的制取装置,制取二氧化硫的原料为:亚硫酸钠和70%的浓硫酸,c装置为Na2S2O3的生成装置,d装置为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体;
(2)反应开始时发生的反应为:Na2S+4SO2+H2O=2H2S+Na2SO3,SO2+2H2S=3S↓+2H2O;
(3)通过控制反应温度、调节酸的滴加速度、调节酸的浓度可以控制SO2生成速率;
(4)硫代硫酸钠遇酸易分解,若通入的SO2过量,则溶液显酸性,硫代硫酸钠会分解;
(5)将产品溶于水后检验溶液中是否含有SO42-即可;
(6)利用铁氰化钾溶液检验反应后的溶液中含有Fe2+;混合后溶液先变成紫黑色,30s后溶液几乎变为无色,说明Fe3++3S2O32-![]() Fe(S2O3)33-反应速率快于Fe3+和S2O32-之间的氧化还原反应,且促进平衡逆向移动;先变成紫黑色后变无色,说明生成紫色配合物的反应速率快,氧化还原反应速率慢;另外Fe3+与S2O32-氧化还原反应的程度大,导致Fe3++3S2O32-
Fe(S2O3)33-反应速率快于Fe3+和S2O32-之间的氧化还原反应,且促进平衡逆向移动;先变成紫黑色后变无色,说明生成紫色配合物的反应速率快,氧化还原反应速率慢;另外Fe3+与S2O32-氧化还原反应的程度大,导致Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色;
Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色;
(7)实验②滴加AgNO3溶液,先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液,说明溶液中Ag+较低,减少了发生氧化还原反应的可能;
(8)Ag2S2O3中S元素化合价为+2价,生成的Ag2S中S元素化合价为-2价,是还原产物,则未知产物应是氧化产物,结合电子守恒,原子守恒分析即可;
(9)结合试验①、②、③从阳离子的氧化性、离子浓度等方面分析。
该实验在容器b中制取SO2,在容器c中制取Na2S2O3,装置d用来吸收尾气中的SO2防止污染空气。
(1)第一个装置为二氧化硫的制取装置,制取二氧化硫的原料为:亚硫酸钠或亚硫酸氢钠和70%的浓硫酸,反应的离子方程式为:SO32-+2H+=SO2↑+H2O或HSO3-+2H+=SO2↑+H2O;c装置为Na2S2O3的生成装置,根据反应原理可知容器c中的试剂为硫化钠和碳酸钠混合溶液,故答案为:SO32-+2H+=SO2↑+H2O或HSO3-+2H+=SO2↑+H2O,硫化钠和碳酸钠混合溶液。
(2)反应开始时发生的反应为:Na2S+4SO2+H2O=2H2S+Na2SO3,SO2+2H2S=3S↓+2H2O;反应生成的硫单质使溶液变浑浊,故答案为:硫。
(3)控制反应温度、调节酸的滴加速度、调节酸的浓度等都可以控制SO2的生成速率,故答案为:控制反应温度、调节酸的滴加速度(或调节酸的浓度等)。
(4)硫代硫酸钠遇酸易分解,若通入的SO2过量,则溶液显酸性,硫代硫酸钠会分解,故答案为:若SO2过量,溶液显酸性,产物分解。
(5)检测产品中是否存在Na2SO4的方法是取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,故答案为:取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质。
(6)实验①的现象是混合后溶液先变成紫黑色,30s后溶液几乎变为无色,取反应后的混合液并加入铁氰化钾溶液,产生蓝色沉淀,则有Fe2+生成,可判断为Fe3+被S2O32-还原为Fe2+,说明Fe3++3S2O32![]() Fe(S2O3)33-反应速率快于Fe3+和S2O32-之间的氧化还原反应,且促进平衡逆向移动;先变成紫黑色后变无色,说明生成紫色配合物的反应速率快,氧化还原反应速率慢;另外Fe3+与S2O32-氧化还原反应的程度大,导致Fe3++3S2O32-
Fe(S2O3)33-反应速率快于Fe3+和S2O32-之间的氧化还原反应,且促进平衡逆向移动;先变成紫黑色后变无色,说明生成紫色配合物的反应速率快,氧化还原反应速率慢;另外Fe3+与S2O32-氧化还原反应的程度大,导致Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色,故答案为:生成紫色配合物的反应速率快,氧化还原反应速率慢;Fe3+与S2O32-氧化还原反应的程度大,Fe3++3S2O32-
Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色,故答案为:生成紫色配合物的反应速率快,氧化还原反应速率慢;Fe3+与S2O32-氧化还原反应的程度大,Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色。
Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色。
(7)同浓度氧化性:Ag+>Fe3+,但实验②为发生Ag+与S2O32-之间的氧化还原反应,结合实验现象先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液,说明Ag+与S2O32-生成稳定的配合物,浓度降低,Ag+的氧化性和S2O32-的还原性减弱,故答案为:Ag+与S2O32-生成稳定的配合物,浓度降低,Ag+的氧化性和S2O32-的还原性减弱。
(8)Ag2S2O3中S元素化合价为+2价,生成的Ag2S中S元素化合价为-2价,是还原产物,则未知产物应是氧化产物,如果产物是H2SO3,能被Ag+继续氧化,则氧化产物应为H2SO4,结合原子守恒可知,另一种反应物应为H2O,发生反应的化学方程式为AgS2O3+H2O=Ag2S+ H2SO4,故答案为:H2O、H2SO4。
(9)结合试验①、②、③可知,Na2S2O3与金属阳离子发生氧化还原反应和金属阳离子的氧化性强弱、离子浓度大小,反应物的用量等有关,故答案为:阳离子、用量等。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】铜及其合金是人类最早使用的金属材料。
(1)基态铜原子的电子排布式为___________________。
(2)图1是Cu2O的晶胞,Cu原子配位数为_________________。
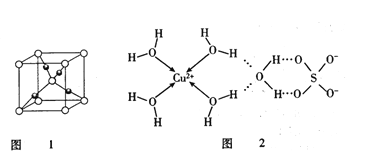
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可表示如图2。
①SO42-中S原子的杂化类型为________________,写出一个与SO42-互为等电子体的分子的化学式____________________。
②胆矾的化学式用配合物的形式可表示为_______________。1mol胆矾所含σ键的数目为:______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. 平衡向正反应方向移动B. a<c+d
C. D的体积分数变大D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用“甲烷蒸气转化法”生产氢气,反应的热化学方程式为CH4(g)+H2O(g)CO2(g)+3H2(g) △H=+161.1kJ·mol-1
(1)已知温度、压强对甲烷平衡时的体积分数的影响如图1,请回答:
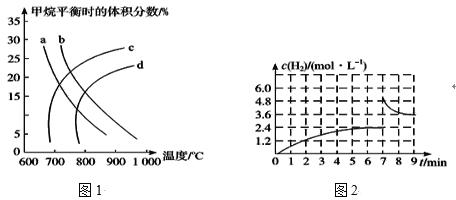
①图1中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷体积分数的曲线,其中表示1MPa的是_____。
②该反应的平衡常数:K(600℃)___(填“>”“<”或“=”)K(700℃)。
(2)①已知:在700℃、1MPa时,1molCH4与1molH2O在1L的密闭容器中反应,6min时达到平衡(如图2),此时CH4的转化率为__,该温度下反应的平衡常数为____(结果保留小数点后一位数字)。
②从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是____(填“向正反应方向”或“向逆反应方向”)移动,采取的措施可能是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2 为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32﹣ 的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L密闭容器中加人反应物A、B,发生如下反应:A+2B=3C.经2min后,A的浓度从开始时的1.0mol/L降到0.8mol/L.已知反应开始时B的浓度是1.2mol/L.则:2min末B的浓度___________、C的物质的量_________,2min内,用A物质的浓度变化来表示该反应的反应速率,即V(A)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学们在实验室里用不同的方法分别制取Cu(NO3)2,并在此基础上探究Cu(NO3)2的化学性质。
(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,反应的化学方程式是___。
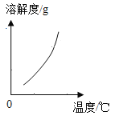
(2)乙组同学查阅了硝酸铜晶体的溶解度曲线(下图),据此设计了以下实验方案,先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、____________、过滤、洗涤、干燥。乙组同学认为此方案优于甲组的方案,理由之一是_____。
(3)丙组同学用Cu(NO3)2晶体,探究其热稳定性,实验装置如下所示。(夹持装置和加热仪器未画出)

①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,红棕色气体是____________。
②集气瓶中最终收集到的气体颜色是____________,U形管中进入集气瓶后颜色发生变化的原因是___。
③欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解],实验方案是___。
④由该实验可得出的结论是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量、浓度等)改变,不会引起产物改变的是 ( )
A. NaOH和CO2B. Fe粉在Cl2中燃烧
C. Na和O2D. Cu和HNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com