
【题目】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:

请回答下列问题:
(1)滤渣1的化学式为_______,
(2)沉淀X的化学式为______________。
(3)“转化Ⅱ”中主要反应的离子方程式为___________________________。
(4)“一系列操作”包括过滤、洗涤、干燥。洗涤沉淀的操作为__________________。
【答案】 SiO2 Fe(OH)3 MnO4﹣+3Fe2++7H2O= MnO2↓+3Fe(OH)3↓+5H+ 3Mn2+ + 2MnO4- + 2H2O = 5MnO2↓+ 4H+ 向过滤器中加入蒸馏水浸没沉淀,待蒸馏水流下后,重复操作2~3次
【解析】闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)用硫酸溶液溶解并过滤后,滤渣为不溶于稀硫酸的SiO2,逸出的气体为H2S,并用空气氧化H2S气体得到S,防污染空气,滤液1中含有FeSO4、ZnSO4及MnSO4等溶质,调整滤液1pH至5,并滴加KMnO4溶液,氧化溶液中的Fe2+和Mn2+,最终得到不溶物MnO2和Fe(OH)3,过滤得滤液2为ZnSO4和K2SO4溶液,在滤液2中滴加Na2CO3溶液,得ZnCO3沉淀,过滤、洗涤并干燥,最终煅烧得到ZnO,据此分析解题。
(1)根据分析知闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3,不溶于稀硫酸的为SiO2,所以滤渣1为SiO2。故答案为:SiO2。
(2)滤液1经氧化并调节溶液PH=5后,得到不溶于水的MnO2和Fe(OH)3,则过滤所得不溶沉淀X为Fe(OH)3故答案为:Fe(OH)3。
(3)转化Ⅱ为用KMnO4氧化溶液中Fe2+,还原产物为Mn2+,根据电子守恒、电荷守恒及原子守恒可得发生反应的离子方程式MnO4-+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+,3Mn2++ 2MnO4-+ 2H2O = 5MnO2↓+ 4H+。故答案为:MnO4-+3Fe2++7H2O= MnO2↓+3Fe(OH)3↓+5H+ ; 3Mn2++ 2MnO4-+ 2H2O = 5MnO2↓+ 4H+
(6)“一系列操作”包括过滤、洗涤、干燥。洗涤不溶物的方法是向过滤器中加入蒸馏水浸没沉淀,待蒸馏水流下后,重复操作23次。故答案为:向过滤器中加入蒸馏水浸没沉淀,待蒸馏水流下后,重复操作23次。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列叙述与胶体性质有关的是( )
A.利用醋酸除去锅炉中的水垢
B.家用滤芯式净水器中利用活性炭净水
C.清晨在树林中可以看到一缕缕光束
D.向氯化铁溶液中滴加氢氧化钠溶液产生红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
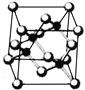
(1)下列说法正确的是__________(填序号)
A.砷化镓晶胞结构与NaCl相同 B.第一电离能 As>Ga
C.电负性 As>Ga D.原子半径 As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_____________________________;
(3)AsH3空间形状为___________;已知(CH3)3 Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因_______________________, Cu2+的核外电子排布式为_______________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有_________和_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
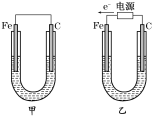
①有红色物质析出的分别是甲、乙装置中的________。
A.甲中的Fe棒,乙中的Fe棒 B.甲中的C棒,乙中的Fe棒
C. 甲中的C 棒,乙中的Fe棒 D.甲中的C棒,乙中的C棒
②乙装置中阳极的电极反应式是:____________________________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:_________________________________________。
②将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:___________。
Ⅱ.如图为绿色电源“甲烷燃料电池”的工作原理示意图。
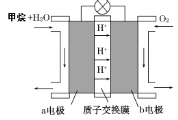
负极的电极反应为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习化学有利于我们认识饮食与健康的关系,养成良好的饮食习惯.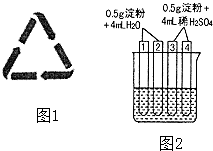
(1)油脂被摄人人体后,在酶的作用下水解为(写名称,下同)和 , 进而被氧化生成并提供能量,或作为合成人体所需其他物质的原料.
(2)发育出现障碍,患营养缺乏症,这主要是由于摄取(填“蛋白质”、“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是 (填字母).
A菠菜 B花生油 C瘦肉 D西瓜
(3)某火腿制品的包装上印有相关配料:精选瘦肉、白糖、淀粉、亚硝酸钠等.火腿中属于防腐剂的是 , 不可长期或大量进食腌制肉类食品的原因是:其包装袋上常可看到如图1所示的图标,它的含义是 , 此包装袋材料是聚乙烯塑料,它的单体是(填结构简式).
(4)如图2所示4支试管同时水浴加热4min.为检验其中淀粉的水解程度,某同学的实验操
作与现象记录如下:
试管 | 操作 | 现象 |
① | 加入碘水 | 溶液变成蓝色 |
② | 加入银氨溶液,水浴加热 | 未出现银镜 |
③ | 加入碘水 | 溶液变成蓝色 |
④ | 加入银氨溶液,水浴加热 | 未出现银镜 |
①结合试管1、2中的现象,得出的结论是:这两支试管中淀粉水解(填“没有”、“部分”或“全部”),淀粉 (填“有”或“没有”)还原性.
②结合试管3、4中的现象,(填“能”或“不能”)得出“这两支试管中淀粉没有水解”的结论,理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )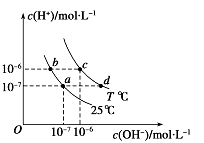
A.只采用升温的方式,可由a点变成d点
B.T<25
C.b点和c点pH均为6,溶液呈酸性
D.两条曲线上任意点均有c (H+) ×c (OH-)=Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。气态时,已知断裂1mol N—N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )

A.N4与N2互称为同位素
B.N4属于一种新型的化合物
C.N4化学性质比N2稳定
D.1mol N4气体转化为N2时要放出882kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中有机物化学键断裂只涉及π键断裂的是( )。
A. CH4的燃烧 B. C2H4与Cl2的加成 C. CH4与Cl2的取代 D. C2H4的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏移的是( )
A.CCl4 B.C2H5OH C.CS2 D.C6H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com