
| A. | H2O | B. | CH3COOH | C. | H2CO3 | D. | C2H5OH |
科目:高中化学 来源: 题型:选择题
| A. | 在不同条件时,有机产物相同,反应类型也相同 | |
| B. | 在不同条件时,反应类型不相同,但生成的无机物完全相同 | |
| C. | 在相同条件时,有机产物可能相同也可能不相同 | |
| D. | 在相同条件时,生成的有机物一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合价升高 | B. | 化合价降低 | C. | 化合价不变 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2,NaClO中含有化学键类型完全相同 | |
| B. | 只有活泼金属元素与活泼非金属元素之间才能形成离子键 | |
| C. | 等物质的量的CN-和N2含有的共用电子对数相等 | |
| D. | 氯气与NaOH反应的过程中,同时有离子键、极性键和非极性键的断裂和形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
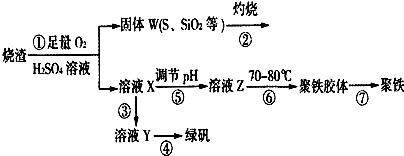
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①② | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
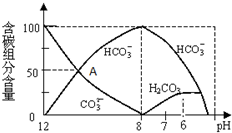 常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示.回答下列问题:
常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com