
| A. | ②③④⑥ | B. | ①③⑥ | C. | ③⑤⑥⑦ | D. | ②③⑥ |
分析 (1)碳酸比硝酸弱,与硝酸钡不反应;
(2)酸性氧化物能与碱反应,过量的CO2与Ca(OH)2 反应:Ca(OH)2+2CO2═Ca(HCO3)2;
(3)碳酸酸性强于硅酸,二氧化碳能与Na2SiO3反应,生成硅酸;
(4)碳酸比盐酸弱,CO2与CaCl2溶液不会反应;
(5)过量的CO2通入饱和Na2CO3溶液中发生反应生成碳酸氢钠;
(6)NaAlO2溶液通入过量的二氧化碳,可生成氢氧化铝沉淀;
(7)可生成碳酸氢钠和氯化铵,为侯氏制碱法原理;
解答 解:(1)碳酸比硝酸弱,与硝酸钡不反应,没有沉淀生成,故错误;
(2)酸性氧化物能与碱反应,过量的CO2与Ca(OH)2 反应:Ca(OH)2+2CO2═Ca(HCO3)2,没有沉淀生成,故错误;
(3)碳酸比硅酸强,过量的CO2与Na2SiO3溶液反应:2CO2+Na2SiO3+2H2O═2NaHCO3+H2SiO3↓,产生硅酸沉淀,故正确;
(4)碳酸比盐酸弱,CO2与CaCl2溶液不会反应,没有沉淀生成,故错误;
(5)过量的CO2通入饱和Na2CO3溶液中发生反应:Na2CO3+H2O+CO2═2NaHCO3↓,因为碳酸氢钠溶解度比碳酸钠小,所以有NaHCO3晶体析出,故正确;
(6)NaAlO2溶液通入过量的二氧化碳,由于碳酸酸性比氢氧化铝强,所以生成氢氧化铝白色沉淀和碳酸氢钠,2H2O+NaAlO2+CO2=Al(OH)3↓+NaHCO3,故正确;
(7)反应发生NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,所以有NaHCO3晶体析出,故正确;
故选C.
点评 本题考查了元素及其化合物的性质,为高考常见题型,侧重于元素化合物知识的综合理解和运用的考查,注意基础知识的掌握,题目难度中等.


科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
常温下,10mL浓度为amol·L-1的醋酸溶液pH=4。下列能使溶液的pH=7的措施是
A.将溶液稀释到 10L
B.将溶液与10mL浓度为amol·L-1的NaOH溶液混合
C.将溶液与10mL、pH=10的NaOH溶液混合
D.往溶液中加入适量的氢氧化钠,使溶液中c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
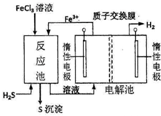 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )| A. | 左槽中发生的反应是:2Cl--2e-═Cl2↑ | |
| B. | 右槽中的反应式:2H++2 e-═H2↑ | |
| C. | H+从电解池左槽迁移到右槽 | |
| D. | FeCl3溶液可以循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
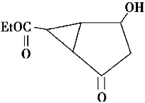 及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )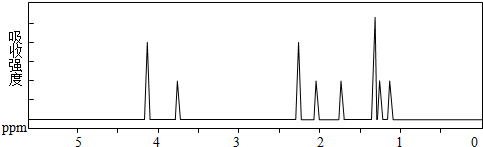
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物的分子式为C9H12O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
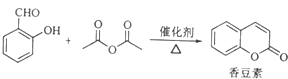
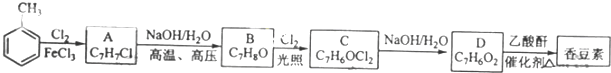
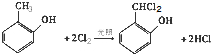 ;
;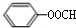 (写结构简式)
(写结构简式)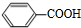 (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCl2完全反应转移电子数一定为2×6.02×1023 | |
| B. | 因SO2具有漂白性,故可使品红溶液、酸性KMnO4溶液褪色 | |
| C. | 常温下,$\frac{c(OH-)}{c(H+)}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存 | |
| D. | 将20.0gNaOH固体置入500mL容量瓶,然后加水至刻度线即得1.00mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应 3A+B 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示:
(1)T0对应的反应速率v正__________v逆。(填“>”“<”或“=”);
(2)此反应的正反应为___________热反应。(填“吸”或“放”);
(3)X、Y两点A物质正反应速率的大小关系是Y___________X;(填“>”“<”或“=”);
(4)若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为____________mol;若Y点时所耗时间为2min,则B物质的反应速率为__________mol/(L·min)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com