
【题目】根据要求回答下列问题:
(1).制取MgCl2的过程中涉及反应:MgCl2.6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
(2).在实验室模拟氯碱工业电解饱和食盐水,用玻璃棒蘸浓氨水检验阳极产生的气体,生成大量白烟。写出化学方程式____________________。直接电解氯化钠稀溶液可制备“84”消毒液,所得消毒液仅含一种溶质,写出相应的化学方程式:___________________,下列措施能增强“84”消毒液杀菌能力的是___________(填序号)
A.加入适量醋酸b.加入适量亚硫酸
c.加入少量NaOH粉末D.加入适量的稀盐酸
(3).生活中常用ClO2净化自来水,将SO2通入硫酸酸化的KClO3可以制备ClO2,氧化剂和还原剂的物质的量之比为__________。有效氯含量可以来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为__________(结果保留小数点后1位)。
(4).某学习小组探究过氧化钠和二氧化硫的化学反应,有同学认为类似于过氧化钠和二氧化碳的反应,有同学认为二氧化硫全被氧化,现向过氧化钠中通入足量的二氧化硫,请设计实验证明二氧化硫部分被氧化:___________________。
【答案】(1).抑制Mg2+的水解(2分)
(2).3Cl2+8NH3=N2+6NH4Cl(2分)
NaCI+NaCI![]() NaClO+H2↑(2分)ad(2分)
NaClO+H2↑(2分)ad(2分)
(3).2:1(2分)1.57(2分)
(4).取反应后的固体少许于试管中,加水溶解,先加足量盐酸,有刺激性气味气体放出,证明有SO32-存在,再加BaCl2溶液有白色沉淀,证明有SO42-存在,故二氧化硫部分氧化。(2分)
【解析】
试题分析:(1)由于镁离子易水解,所以制取MgCl2的反应要在HCl气氛中进行。
(2)阳极产生氯气,氯气能把氨气氧化氨气,同时生成氯化氢,氨气和氯化氢反应生成氯化铵而生成大量白烟,反应的化学方程式为3Cl2+8NH3=N2+6NH4Cl。直接电解氯化钠稀溶液可制备“84”消毒液,所得消毒液仅含一种溶质,该溶质是次氯酸钠,则相应的化学方程式为NaCI+NaCI![]() NaClO+H2↑;A.加入适量醋酸可以使次氯酸钠转化为次氯酸,增强杀菌能力,a正确;b.加入适量亚硫酸,次氯酸钠氧化亚硫酸,降低杀菌能力,b错误;c.加入少量NaOH粉末抑制次氯酸的生成,降低杀菌能力,c错误;D.加入适量的稀盐酸可以使次氯酸钠转化为次氯酸,增强杀菌能力,d正确,答案选ad。
NaClO+H2↑;A.加入适量醋酸可以使次氯酸钠转化为次氯酸,增强杀菌能力,a正确;b.加入适量亚硫酸,次氯酸钠氧化亚硫酸,降低杀菌能力,b错误;c.加入少量NaOH粉末抑制次氯酸的生成,降低杀菌能力,c错误;D.加入适量的稀盐酸可以使次氯酸钠转化为次氯酸,增强杀菌能力,d正确,答案选ad。
(3)将SO2通入硫酸酸化的KClO3可以制备ClO2,氧化剂中氯元素的化合价从+5价降低到+4价,得到1个电子,还原剂中S元素的化合价从+4价升高到+6价,失去2个电子,则根据电子得失守恒可知氧化剂和还原剂的物质的量之比为2:1。得到2mol电子,需要1mol氯气和0.5molNaClO2,所以NaClO2的有效氯含量为![]() 。
。
(4)如果部分被氧化,则一定生成亚硫酸钠和硫酸钠生成,则证明二氧化硫部分被氧化的实验方案为取反应后的固体少许于试管中,加水溶解,先加足量盐酸,有刺激性气味气体放出,证明有SO32-存在,再加BaCl2溶液有白色沉淀,证明有SO42-存在,故二氧化硫部分氧化。


科目:高中化学 来源: 题型:
【题目】(1)欲验证某溶液中含有较大量的Cl-、CO![]() 、SO
、SO![]() 三种离子,如果只取一次该溶液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)________________、_______________、______________。
三种离子,如果只取一次该溶液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)________________、_______________、______________。
(2)溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序写出对应的离子方程式_____________、______________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素及其化合物的说法中正确的是( )
A.Fe为活泼金属,常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应
B.Na久置于空气中,可以和空气中的有关物质发生反应,最终生成NaHCO3
C.铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料
D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
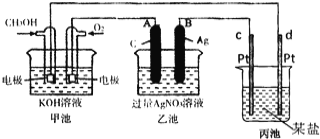
(1)请回答图中甲池是___________装置,其中OH-移向___________极(填“正”或“负”)
(2)写出通入CH3OH的电极反应式是___ .
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为___________极(填“A”或“B”),并写出此电极反应的电极反应式____ .
(4)乙池中反应的离子方程式为___ .
(5)当乙池中B(Ag)极的质量增加2.70g时,乙池的pH是___________(若此时乙池中溶液的体积为250mL);此时丙池某电极析出0.80g某金属,则丙中的某盐溶液可能是___________(填序号)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水常用Cl2消毒,某学生在实验室用这种自来水去配制下列物质的溶液,不会产生明显药品变质问题的是( )
① NaBr ② FeCl3 ③ Na2SO3 ④ AlCl3 ⑤ FeSO4 ⑥ NaHCO3
A.①③ B.②④ C.③④⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A.NaCl B.H2SO4 C.CuCl2 D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用图Ⅰ所示的装置验证一些物质的性质。下列说法错误的是
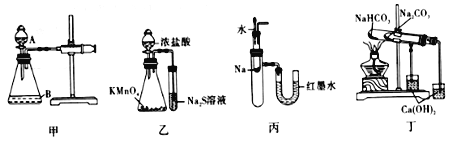
A.图甲中,为检查装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
B.图已中,可以比较KMnO4、Cl2和S氧化性的相对强弱
C.将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升
D.图丁中,可用装置验证NaHCO3和Na2CO3的热稳定性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.0.5molCl2通入足量水中充分反应.转移的电子数等于0.5NA
B.46gNO2和N2O4混合气体中含有原子总数为3NA
C.标准状况下,22.4LSO3中含有的分子数为NA.
D.1L0.1mol/L的NaHSO3溶液中,HSO32-、SO32-的离子数之和为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com