
| A、将水杨酸、乙酸酐和浓硫酸在锥形瓶中混合后,85-90℃水浴加热5-10min,取出锥形瓶,置于冰水浴中,使阿司匹林结晶析出,为了使其结晶完全需要向锥形瓶中继续加适量的水 |
| B、用移液管取液后,将移液管稍倾斜放入锥形瓶中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
| C、相同条件下,10mL 0.1mol/L FeCl2溶液中滴入1mL 0.1mol/L NaNO2溶液,溶液颜色由浅绿色变成黄色,10mL 0.1mol/L KI溶液中滴入1mL 0.1mol/L NaNO2溶液,溶液颜色无变化,说明溶液的pH会影响NO2-的氧化性 |
| D、为了检验火柴头中的硫元素,先用刀片削下几根火柴的火柴头,放入一支中号试管中,先用酒精灯加热该试管底部引燃“火药”,然后塞上橡皮塞待用 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、从海水提取物质都必须通过化学反应才能实现 |
| B、合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
| C、光化学烟雾不会引起呼吸道疾病 |
| D、维生素C具有还原性,在人体内起抗氧化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA个氧分子和NA和氢分子的质量比为8:1 |
| B、11.2L氢气中含有的原子数为NA个 |
| C、54g水中含有分子数为3NA个 |
| D、1mol/L硫酸钠溶液中硫酸根离子离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、棉、麻、丝、合成纤维完全燃烧生成物中都含有CO2和H2O |
| B、日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
| C、兰州水污染苯超标是由于石油泄漏,污染物以烃类为主 |
| D、雾霾天车灯的通路属于丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol?L-1 NaClO溶液和0.1mol?L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第ⅠA族元素都比第ⅡA族元素金属性强 |
| B、只含有非金属元素的化合物可能是离子化合物 |
| C、只含有共价键的物质一定是共价化合物 |
| D、同主族元素原子半径越小越容易失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ?mol-1 | 890.3 | 1299.6 | 285.8 |
| A、C≡C键能为796.0 kJ?mol-1 |
| B、C-H键键长小于H-H键 |
| C、2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ?mol-1 |
| D、2CH4(g)═C2H2(g)+3H2(g)△H=-376.4 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
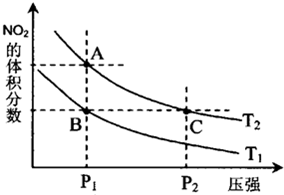 试运用所学知识,解决下列问题:
试运用所学知识,解决下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com