
| A、检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
| B、向做完蔗糖水解后的溶液中直接加入新制的Cu(OH)2并加热,以检验蔗糖是否水解 |
| C、将混有HCl的CO2通入饱和Na2CO3溶液中除去HCl |
| D、将Al2(SO4)3溶液蒸干制备Al2(SO4)3固体 |


科目:高中化学 来源: 题型:
| A、c(H+)<c(OH-)的溶液中,Na+、K+、SO42-、ClO- |
| B、能使酚酞变红的溶液中:Na+、Cu2+、CO32-、NO3- |
| C、0.1mol?L-1FeCl3溶液中:K+、NH4-、I-、SCN- |
| D、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
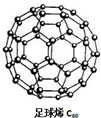 C60可用作储存氢气的材料,结构如图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
C60可用作储存氢气的材料,结构如图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )| A、C60、Si60、N60都属于原子晶体 |
| B、C60、Si60、N60分子内共用电子对数目相同 |
| C、由于N-N键能小于N≡N,故N60的稳定性弱于N2 |
| D、由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
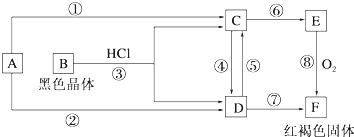
查看答案和解析>>
科目:高中化学 来源: 题型:
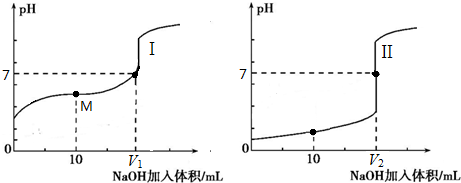 电解质的水溶液中存在电离平衡.
电解质的水溶液中存在电离平衡.| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol?L-1 AgNO3溶液中加入2mL 0.005mol?L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol?L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol?L-1AgNO3溶液. | |
| 步骤4:向步骤1余下的浊液中加入5滴3mol?L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B、当恰好完全中和时,溶液呈中性 |
| C、当滴入少量的NaOH,促进了HA的电离,溶液的pH升高 |
| D、当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
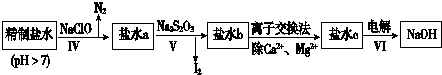
查看答案和解析>>
科目:高中化学 来源: 题型:
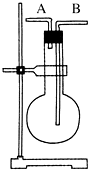 ①H2②Cl2③NH3④O2⑤CH4⑥NO ⑦NO2⑧SO2⑨HCl.
①H2②Cl2③NH3④O2⑤CH4⑥NO ⑦NO2⑧SO2⑨HCl.| A、在烧瓶中充满水,由B进气收集④⑥ |
| B、在烧瓶中充满水,由A进气收集①③⑤⑥⑦ |
| C、烧瓶是干燥的,由B进气收集②④⑥⑦⑧⑨ |
| D、烧瓶是干燥的,由A进气收集①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Al3+、CO32-、Cl- |
| B、Na+、H+、SO42-、SiO32- |
| C、H+、Mg2+、SO42-、I- |
| D、H+、Fe2+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com