
| A. | CH3COOH溶液中CH3COOH的电离:CH3COOH=H ++CH3COO- | |
| B. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- | |
| C. | NaHCO3溶液中HCO3-的水解:HCO3-+H2 O?H3 O ++CO32- | |
| D. | 将FeCl3溶液滴入Na2CO3溶液中:2Fe3++3 CO32?+3 H2 O═2Fe(OH)3↓+3 CO2↑ |
分析 A.弱酸在溶液中部分电离;
B.电解CuCl2溶液生成Cu和氯气;
C.HCO3-水解生成碳酸;
D.FeCl3溶液与Na2CO3溶液发生相互促进的水解反应生成氢氧化铁沉淀和二氧化碳气体.
解答 解:A.弱酸在溶液中部分电离,则CH3COOH溶液中CH3COOH的电离:CH3COOH?H++CH3COO-,故A错误;
B.电解CuCl2溶液生成Cu和氯气,所以用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,故B错误;
C.HCO3-水解生成碳酸,则NaHCO3溶液中HCO3-的水解方程式:HCO3-+H2O?OH-+H2CO3,故C错误;
D.FeCl3溶液与Na2CO3溶液发生相互促进的水解反应生成氢氧化铁沉淀和二氧化碳气体,反应的方程式为:2Fe3++3CO32?+3H2O═2Fe(OH)3↓+3CO2↑,故D正确.
故选D.
点评 本题考查了弱电解质的电离和盐的水解,题目侧重于电离方程式和水解方程式书写的考查,题目难度不大,注意把握酸式盐的电离方程式与水解方程式 的区别.


科目:高中化学 来源: 题型:解答题
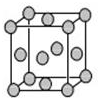 已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.
已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1, I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
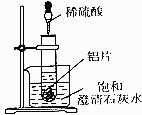 如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.
如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | M 中一定不含Mg(OH)2 | B. | M中一定含有MgCO3 | ||
| C. | 5.78 g M中含CaCO30.05mol | D. | 水垢中碳酸盐质量分数为0.823 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 | |
| B. | 应该选择酚酞作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量盐酸 | B. | 加热 | ||
| C. | 加少量醋酸钠晶体 | D. | 加少量NaOH晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
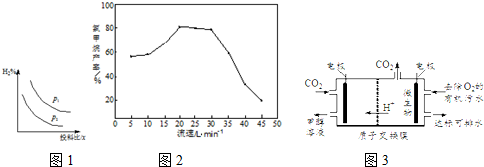
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
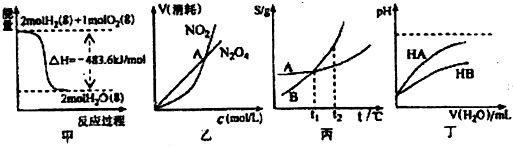
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-l | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B=A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | HA | BOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HA)<V(BOH) |
| ② | 强酸 | 强碱 | V(HA)=V(BOH) |
| ③ | 强酸 | 弱碱 | V(HA)>V(BOH) |
| ④ | 弱酸 | 强碱 | V(HA)>V(BOH) |
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com