
 )为原料合成,路线如下(部分反应条件略):
)为原料合成,路线如下(部分反应条件略):



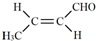 .
.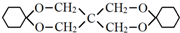 .
.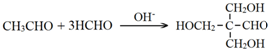 .
. 分析 根据X的结构简式和D的分子式可知,D为CH2=CHCOOH,F为C(CH2OH)4,根据转化关系A发生信息Ⅱ中的反应生成E,E发生加成反应生成F,所以A为CH3CHO,E为(CH2OH)3CCHO,根据D的结构简式可逆推得A与甲醛发生信息Ⅱ中的反应生成B为HOCH2CH2CHO,B发生消去反应生成C为CH2=CHCHO,C发生氧化反应得D,环已烯与溴化氢加成得G为1-溴环已烷,G发生碱性水解得H为环已醇,环已醇发生氧化反应得环已酮,根据Y的分子式可知,环已酮与F发生信息Ⅲ中的反应得Y为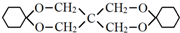 ,据此答题.
,据此答题.
解答 解:根据X的结构简式和D的分子式可知,D为CH2=CHCOOH,F为C(CH2OH)4,根据转化关系A发生信息Ⅱ中的反应生成E,E发生加成反应生成F,所以A为CH3CHO,E为(CH2OH)3CCHO,根据D的结构简式可逆推得A与甲醛发生信息Ⅱ中的反应生成B为HOCH2CH2CHO,B发生消去反应生成C为CH2=CHCHO,C发生氧化反应得D,环已烯与溴化氢加成得G为1-溴环已烷,G发生碱性水解得H为环已醇,环已醇发生氧化反应得环已酮,根据Y的分子式可知,环已酮与F发生信息Ⅲ中的反应得Y为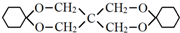 ,
,
(1)根据X的结构简式可知,X中含氧官能团的名称是 酯基,
故答案为:酯基;
(2)A为CH3CHO,A的化学式是 C2H4O,
故答案为:C2H4O;
(3)C为CH2=CHCHO,C的同系物,用结构简式表示其反式结构为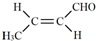 ,
,
故答案为: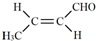 ;
;
(4)G为1-溴环已烷,H为环已醇,
a.H中有羟基能与钠生成气体,而G中没有,所以可以用金属钠可以区别G和H,故a正确;
b.G、H经消去反应都可得到环己烯,故b正确;
c.H是醇与苯酚的化学性质不相似,故c错误;
d.卤代烃的消去反应在氢氧化钠醇溶液中进行,所以试剂a是氢氧化钠醇溶液,故d错误;
故选a b;
(5)根据上面的分析可知,①为加成反应,③、④也为加成反应,所以反应②、③、④、⑤中与反应①的类型相同的是 ③、④,
故答案为:③、④;
(6)根据上面的分析可知,Y的结构简式是 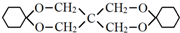 ,
,
故答案为: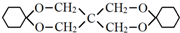 ;
;
(7)A→E的化学方程式是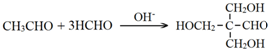 ,
,
故答案为: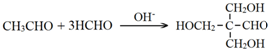 .
.
点评 本题考查有机物的推断,需要学生对给予的信息进行利用,能较好的考查学生的自学能力,利用正推法与逆推法相结合进行推断,需要熟练掌握官能团的性质,难度中等.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基-CH3 | B. | 羟基-OH- | C. | 醛基-CHO | D. | 羧基-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验 目的 | 实验内容 | 实验现象 | 实验结论 | 离子方程式 |
| 实验1 | ① | 在FeCl2溶液中滴入适量 氯水 | 溶液由浅绿色 变为黄色 | ② | ③ |
| 实验2 | ④ | 在FeCl2溶液中加入锌片 | / | ⑤ | Zn+Fe2+═Zn2++Fe |
| 实验3 | ⑥ | 在FeCl3溶液中加入足量 铁粉 | ⑦ | FeCl3(Fe3+)具有氧化性 | ⑧ |
| 实验4 | ⑨ | 在FeCl3溶液中滴入适量KI溶液和 淀粉溶液 | 淀粉溶液变蓝 | ⑩ | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸盐作为食品添加剂作用是防腐保鲜 | |
| B. | 反应①中通入N2的作用是将生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
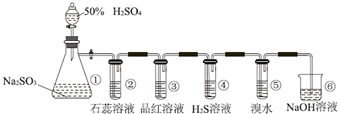
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
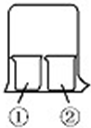 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| ①中的物质 | ②中的物质 | 预测①的现象 | |
| A | 酚酞溶液 | 浓盐酸 | 无明显现象 |
| B | 淀粉KI溶液 | 浓硝酸 | 无明显现象 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加5 mL水,c (H+)增大 | B. | 加少量NaCl固体,c (H+)不变 | ||
| C. | 加少量碳酸钙粉末,c(HClO)升高 | D. | 加少量Na2SO3固体,溶液pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
向2mL0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 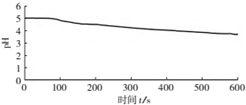 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 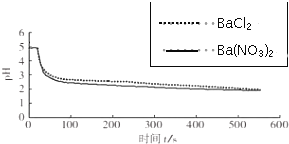 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com