
对于工农业生产和日常生活中与化学有关的问题,下列认识不正确的是
A.含有氯化钠融雪剂的使用会加快桥梁的腐蚀
B.铝合金的大量使用是因为人们能用焦炭等还原剂从氧化铝中获取铝
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅
D.高温结构陶瓷氮化硅(Si3N4)具有较高的硬度和耐磨性,可用于制造汽车发动机
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源:2014-2015学年安徽省江南十校高三上学期期末联考理综化学试卷(解析版) 题型:填空题
(14分)X、Y、及W是短周期中的四种元素,其原子序数依次增大。相关信息如下表
元素 | 相关信息 |
X | 具有多种同素异形体,形成的化合物种类繁多 |
Y | 短周期主族元素中原子半径最大 |
Z | 位于元素周期表金属与非金属元素的分界线上,最高化合价为十4 |
W | 富集在海水中的元素,它的某些化合物常用作消毒刹 |
(1)Z元素基态原子的核外电子排布式为 ,其未成对的电子数目为 。
(2)Y位于元素周期表中第 周期,第 族,四种元素的电负性由大到水的顺序是 (写元素符号)。
(3)氢化物中X-H和W-H的化学键极性较强的是 ,耐磨材料(XY)和单质y 熔点较高的
是 (均用元素符号表示)。
(4)已知400 ℃时,HW 可被氧气催化氧化生成W 的单质,从而实现化更生产上W的循环利用。若断开1mo1H一W化学键,该反应放热28.9KJ,试写出相应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:选择题
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g) △H= Q kJ/mol (Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g) △H= Q kJ/mol (Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol, 则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市七校高三上学期期末联考理综化学试卷 (解析版) 题型:选择题
有关实验的叙述,正确的是
A.将浓硫酸加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的硫酸溶液
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值
C.用 溶液洗涤并灼烧铂丝后,再进行焰色反应
溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取量筒内液体的体积,俯视读数导致读数偏大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省协作体高三上学期第二次月考化学试卷(解析版) 题型:选择题
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ cCl2↑+ dHClO4 + eH2O用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO3
B.若化学计量数a=8,b=3,则该反应转移电子数为20e-
C.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12 + I2 + 6H2O = 12H+ + 8Cl-+ 2IO3-
D.若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:推断题
(10分)短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族;E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6。
(1)E在元素周期表中的位置是 。
(2)由A、C、F三种元素按原子个数比1∶1∶1组成的化合物与BA3反应生成B的单质, 写出该反应的化学方式 。
(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(4)用图所示装置电解由D与F形成盐的饱和溶液时,若阴、阳极都用铁作电极,则阳极的电极反应式为 ,溶液中出现的现象是 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的位置如下表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是
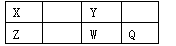
A.W得电子能力比Q强
B.由Z与Y组成的物质在熔融时能导电
C.钠与Y可能形成Na2Y 2化合物且该化合物离子键和共价键
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:填空题
(7分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,
用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(NH4+) (填“=”、“>”“<”)NH4HSO4中c(NH4+)。
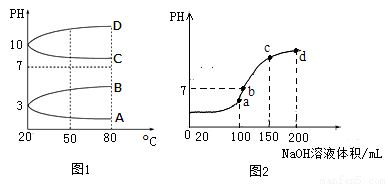
(2)如图1是0.1mol?L﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1mol?L﹣1 NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②室温时,0.1mol?L﹣1 NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)= mol?L﹣1(填数值)
(3)室温时,向100mL 0.1mol?L﹣1 NH4HSO4溶液中滴加0.1mol?L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:填空题
[化学──选修3:物质结构与性质](15分)
稀土元素是指元素周期表中原子序数为57 到71 的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素。稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,其基态原子M能层电子数为 。镝(Dy)的基态原电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为 。
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据判断表中最有可能有+4价的元素是 。
几种稀土元素的电离能(单位:kJ·mol-1)
元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
(3)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有 。
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为 ,1mol CH2=CH2中含有的σ键数目为 。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是 。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有 个氧原子。
(6)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm。晶胞中Ce(铈)原子的配位数为 ,列式表示Ce(铈)单质的密度: g·cm-3(不必计算出结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com