
ЖыіөОІЖшЦРә¬УРCOЎўNO2өИУР¶ҫЖшМеЈ¬¶ФЖыіөјУЧ°ОІЖшҫ»»ҜЧ°ЦГЈ¬ҝЙК№УР¶ҫЖшМеПа»Ҙ·ҙУҰЧӘ»ҜОӘОЮ¶ҫЖшМеЎЈ
ЈЁ1Ј©ЖыіөОІЖшЦРCOЎўNO2ЖшМеФЪТ»¶ЁМхјюПВҝЙТФ·ўЙъ·ҙУҰЈә
4CO(g)+2NO2(g) 4CO2(g)+N2(g)ЎЎҰӨH=Јӯ1200 kJЎӨmolЈӯ1
4CO2(g)+N2(g)ЎЎҰӨH=Јӯ1200 kJЎӨmolЈӯ1
ўЩәгОВәгИЭМхјюПВЈ¬І»ДЬЛөГчёГ·ҙУҰТСҙпөҪЖҪәвЧҙМ¬өДКЗ________(МоРтәЕ)Ј»
AЈ®ИЭЖчДЪ»мәПЖшМеСХЙ«І»ФЩұд»Ҝ BЈ®ИЭЖчДЪөДС№ЗҝұЈіЦІ»ұд
CЈ®2vДж(NO2)=vХэ(N2) DЈ®ИЭЖчДЪ»мәПЖшМеГЬ¶ИұЈіЦІ»ұд
ўЪДЬК№ёГ·ҙУҰөД·ҙУҰЛЩВКФцҙуЈ¬ЗТЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶ҜөДКЗ________(МоРтәЕ)Ј»
AЈ®ј°Кұ·ЦАліцCO2 BЈ®ККөұЙэёЯОВ¶И
CЈ®јхРЎИЭЖчМе»эК№МеПөС№ЗҝФцҙу DЈ®СЎФсёЯР§ҙЯ»ҜјБ
ўЫ¶ФУЪёГ·ҙУҰЈ¬ОВ¶ИІ»Н¬(T2>T1)ЎўЖдЛыМхјюПаН¬КұЈ¬ПВБРНјПсХэИ·өДКЗ________(МоРтәЕ)Ј»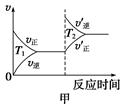
ЈЁ2Ј©ЖыіөОІЖшЦРCOУлH2O(g)ФЪТ»¶ЁМхјюПВҝЙТФ·ўЙъ·ҙУҰЈәCO(g)+H2O(g) CO2(g)+H2(g) ҰӨH<0Ј»820 ЎжКұФЪјЧЎўТТЎўұыИэёцәгИЭГЬұХИЭЖчЦРЈ¬ЖрКјКұ°ҙХХУТұнҪшРРН¶БПЈ¬ҙпөҪЖҪәвЧҙМ¬КұK=1.0ЎЈ
CO2(g)+H2(g) ҰӨH<0Ј»820 ЎжКұФЪјЧЎўТТЎўұыИэёцәгИЭГЬұХИЭЖчЦРЈ¬ЖрКјКұ°ҙХХУТұнҪшРРН¶БПЈ¬ҙпөҪЖҪәвЧҙМ¬КұK=1.0ЎЈ
| ЖрКјОпЦКөДБҝ | јЧ | ТТ | ұы |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
ЈЁ15·ЦЈ©
ЈЁ1Ј© ўЩ C DЎЎ ўЪ B ўЫ ТТЈЁёч2·ЦЈ©
ЈЁ2Ј© ўЩK=" c" (CO2)ЎӨc (H2)ЈҜ[c (CO)ЎӨc (H2O)]ЈЁ2·ЦЈ© 50% ЈЁ3·ЦЈ©
ўЪЎЎ> = ЈЁёч2·ЦЈ©ЎЎ
ҪвОцКФМв·ЦОцЈәЈЁ1Ј©ўЩ·ҙУҰМеПөЦРЦ»УР¶юСх»ҜөӘКЗәмЧШЙ«ЖшМеЈ¬ЖдУаҫщОӘОЮЙ«ЖшМеЈ¬ИЭЖчДЪЖшМеСХЙ«І»ФЩұд»ҜЈ¬ЛөГч¶юСх»ҜөӘЕЁ¶ИІ»ФЩұд»ҜЈ¬јҙ·ҙУҰҙпөҪЖҪәвЈ¬№КAҙнОуЈ»Иф·ҙУҰХэПтҪшРРЈ¬УЙУЪХэ·ҙУҰКЗЖшМеОпЦКөДБҝјхРЎөД·ҙУҰЈ¬ТтҙЛИЭЖчДЪ»мәПЖшМеөДС№ЗҝЦрҪҘјхРЎЈ¬ИфС№ЗҝұЈіЦІ»ұдЈ¬ЛөГчёчЧй·ЦөДОпЦКөДБҝұЈіЦІ»ұдЈ¬јҙ·ҙУҰҙпөҪЖҪәвЈ¬№КBҙнОуЈ»Н¬Т»ОпЦКұнКҫөДvДж= vХэЈ¬І»Н¬ОпЦКұнКҫДж·ҙУҰЛЩВКәНХэ·ҙУҰЛЩВКЦ®ұИөИУЪ»ҜС§·ҪіМКҪЦР¶ФУҰПөКэЦ®ұИЈ¬¶јДЬЛөГч·ҙУҰҙпөҪЖҪәвЈ¬јҙvДж(NO2)/vХэ(N2)=2/1Ј¬ЛщТФvДж(NO2)=2vХэ(N2)ДЬЛөГч·ҙУҰҙпөҪЖҪәвЈ¬¶ш2vДж(NO2)=vХэ(N2)І»ДЬЛөГч·ҙУҰҙпөҪЖҪәвЈ¬№КCХэИ·Ј»»мәПЖшМеөДГЬ¶ИөИУЪЦКБҝіэТФИЭЖчөДИЭ»эЈ¬УЙУЪ·ҙУҰОпәНЙъіЙОп¶јКЗЖшМеЈ¬·ҙУҰЧсСӯЦКБҝКШәг¶ЁВЙЈ¬Фт»мәПЖшМеЧЬЦКБҝКјЦХІ»ұдЈ¬УЙУЪИЭЖчөДМе»эІ»ұдЈ¬Фт»мәПЖшМеөДГЬ¶ИКјЦХІ»»бёДұдЈ¬ТтҙЛГЬ¶ИІ»ұдІ»ДЬЛөГч·ҙУҰҙпөҪЖҪәвЈ¬№КDХэИ·Ј»ўЪј°Кұ·ЦАліц¶юСх»ҜМјЈ¬јҙјхРЎЙъіЙОпЕЁ¶ИЈ¬·ҙУҰЛЩВКјхРЎЈ¬ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬№КAҙнОуЈ»ҰӨH=Јӯ1200 kJЎӨmolЈӯ1Ј¬ФтХэ·ҙУҰКЗ·ЕИИ·ҙУҰЈ¬ЙэёЯОВ¶ИЈ¬·ҙУҰЛЩВКФцҙуЈ¬ЖҪәвПтОьИИ·ҙУҰ»тДж·ҙУҰ·ҪПтТЖ¶ҜЈ¬№КBХэИ·Ј»Хэ·ҙУҰКЗЖшМеМе»эјхРЎөД·ҪПтЈ¬јхРЎИЭЖчМе»эФцҙуС№ЗҝЈ¬Фцҙу·ҙУҰОпәНЙъіЙОпЕЁ¶ИЈ¬·ҙУҰЛЩВКФцҙуЈ¬ЖҪәвПтЖшМеМе»эјхРЎ»тХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬№КCҙнОуЈ»СЎФсёЯР§ҙЯ»ҜјБЈ¬ДЬФцҙу·ҙУҰЛЩВКЈ¬ө«КЗ¶ФЖҪәвОЮУ°ПмЈ¬ЖҪәвІ»ТЖ¶ҜЈ¬№КDҙнОуЈ»ўЫЖҪәвКұЙэёЯОВ¶ИЈ¬ХэДж·ҙУҰЛЩВК¶ј»бН»И»ФцҙуЈ¬ЗТОьИИ·ҙУҰ·ҪПтөДЛЩВКФцҙуіМ¶ИҙуУЪ·ЕИИ·ҙУҰ·ҪПтөДЛЩВКЈ¬јҙДж·ҙУҰЛЩВК>Хэ·ҙУҰЛЩВК>ФӯЖҪәвКұөДХэДж·ҙУҰЛЩВК=ФӯЖҪәвКұөДДж·ҙУҰЛЩВКЈ¬№КјЧНјҙнОуЈ»ЙэёЯОВ¶ИЈ¬·ҙУҰЛЩВКјУҝмЈ¬ЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶ҜЈ¬јИДЬЛх¶МҙпөҪЖҪәвөДКұјдЈ¬УЦДЬК№·ҙУҰОпөДЖҪәвЧӘ»ҜВКјхРЎЈ¬ФтT2КұЗъПЯұИT1КұПИҙпөҪЖҪәвЈ¬ЖҪәвКұ¶юСх»ҜөӘөДЧӘ»ҜВКҪөөНЈ¬№КТТНјХэИ·Ј»ФцҙуС№ЗҝЈ¬ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬·ҙУҰОпөДОпЦКөДБҝјхРЎЈ¬ФтТ»Сх»ҜМјөДМе»э·ЦКэЦрҪҘјхРЎЈ¬¶ш·ЗФцҙуЈ»ЙэёЯОВ¶ИЈ¬ЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶ҜЈ¬·ҙУҰОпөДОпЦКөДБҝФцҙуЈ¬ФтТ»Сх»ҜМјөДМе»э·ЦКэФцҙ󣬶ш·ЗјхРЎЈ¬№КұыНјҙнОуЈ»ЈЁ2Ј©ўЩЖҪәвіЈКэөИУЪЖҪәвКұЙъіЙОпЕЁ¶ИГЭЦ®»эУл·ҙУҰОпЕЁ¶ИГЭЦ®»эөДұИЦөЈ¬ФтCO(g)+H2O(g) CO2(g)+H2(g)өДЖҪәвіЈКэKөДұнҙпКҪОӘ
CO2(g)+H2(g)өДЖҪәвіЈКэKөДұнҙпКҪОӘ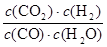 Ј»УЙУЪИЭЖчИЭ»эОҙЦӘЈ¬ОӘБЛјтұгјЖЛг№эіМЈ¬ҝЙЙиИЭ»эОӘ1LЈ¬јЧИЭЖчЦРCOөДұд»ҜЕЁ¶ИОӘx molЎӨLЈӯ1Ј¬ПИЗуёГ·ҙУҰЦРёчЧй·ЦөДЈЁЖрКјЎўұд»ҜЎўЖҪәвЈ©ЕЁ¶ИЈ¬ФтЈә
Ј»УЙУЪИЭЖчИЭ»эОҙЦӘЈ¬ОӘБЛјтұгјЖЛг№эіМЈ¬ҝЙЙиИЭ»эОӘ1LЈ¬јЧИЭЖчЦРCOөДұд»ҜЕЁ¶ИОӘx molЎӨLЈӯ1Ј¬ПИЗуёГ·ҙУҰЦРёчЧй·ЦөДЈЁЖрКјЎўұд»ҜЎўЖҪәвЈ©ЕЁ¶ИЈ¬ФтЈә
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ЖрКјЕЁ¶И/molЎӨLЈӯ1 0.10 0.10 0 0
ұд»ҜЕЁ¶И/molЎӨLЈӯ1 x x x x
ЖҪәвЕЁ¶И/molЎӨLЈӯ1 0.10ЎӘx 0.10ЎӘx x x
K=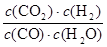 =
=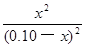 =1.0
=1.0
ҪвөГЈәx =0.050
ўЪ1Ј©јЧЎъТТЈ¬ҫНКЗФцҙуЛ®ХфЖшөДЕЁ¶ИЈ¬ФцҙуТ»ЦЦ·ҙУҰОпЕЁ¶ИЈ¬ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬БнТ»ЦЦ·ҙУҰОпөДЧӘ»ҜВКФцҙуЈ¬ФтТ»Сх»ҜМјөДЖҪәвЧӘ»ҜВКЈәјЧ<ТТЈЁ»тХЯНЁ№эјЖЛгұИҪПЈ©Ј»
ҝЙЙиИЭ»эОӘ1LЈ¬ТТИЭЖчЦРCOөДұд»ҜЕЁ¶ИОӘy molЎӨLЈӯ1Ј¬ПИЗуёГ·ҙУҰЦРёчЧй·ЦөДЈЁЖрКјЎўұд»ҜЎўЖҪәвЈ©ЕЁ¶ИЈ¬ФтЈә
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ЖрКјЕЁ¶И/molЎӨLЈӯ1 0.10 0.20 0 0
ұд»ҜЕЁ¶И/molЎӨLЈӯ1 y y y y
ЖҪәвЕЁ¶И/molЎӨLЈӯ1 0.10ЎӘy 0.20ЎӘy y y
K=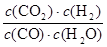 =
=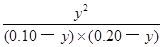 =1.0
=1.0
ҪвөГЈәy =0.20/3
ФтЖҪәвКұТТИЭЖчЦРТ»Сх»ҜМјөДЖҪәвЧӘ»ҜВКОӘЈә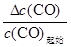 ЎБ100%=
ЎБ100%=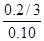 ЎБ100%=67%>50%ЎЈ
ЎБ100%=67%>50%ЎЈ
2Ј©јЧЎъұыЈ¬ЖрКјН¶БПјУұ¶ЎўН¶БПұИІ»ұдЈ¬ҫНКЗФцҙуБҪЦЦ·ҙУҰОпЕЁ¶ИФцҙуС№ЗҝЈ¬УЙУЪХэ·ҙУҰКЗЖшМеМе»эІ»ұдөД·ҙУҰЈ¬ФтЖҪәвІ»ТЖ¶ҜЈ¬Т»Сх»ҜМјЖҪәвЧӘ»ҜВКұЈіЦІ»ұдЈ¬ФтТ»Сх»ҜМјөДЖҪәвЧӘ»ҜВКЈәјЧ=ұыЈЁ»тХЯНЁ№эјЖЛгұИҪПЈ©Ј»
ҝЙЙиИЭ»эОӘ1LЈ¬ұыИЭЖчЦРCOөДұд»ҜЕЁ¶ИОӘz molЎӨLЈӯ1Ј¬ПИЗуёГ·ҙУҰЦРёчЧй·ЦөДЈЁЖрКјЎўұд»ҜЎўЖҪәвЈ©ЕЁ¶ИЈ¬ФтЈә
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ЖрКјЕЁ¶И/molЎӨLЈӯ1 0.20 0.20 0 0
ұд»ҜЕЁ¶И/molЎӨLЈӯ1 z z z z
ЖҪәвЕЁ¶И/molЎӨLЈӯ1 0.20ЎӘz 0.20ЎӘz z z
K=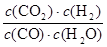 =
=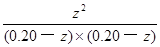 =1.0
=1.0
ҪвөГЈәz =0.10
ФтЖҪәвКұұыИЭЖчЦРТ»Сх»ҜМјөДЖҪәвЧӘ»ҜВКОӘЈә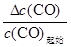 ЎБ100%=
ЎБ100%=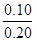 ЎБ100%=50%ЎЈ
ЎБ100%=50%ЎЈ
ҝјөгЈәҝјІй»ҜС§·ҙУҰФӯАнЈ¬Йжј°»ҜС§ЖҪәвөДЕР¶ПТАҫЭЎўНвҪзМхјю¶Ф»ҜС§·ҙУҰЛЩВКәНЖҪәвТЖ¶ҜөДУ°ПмЎў»ҜС§·ҙУҰЛЩВКәН»ҜС§ЖҪәвНјПсЎўЖҪәвіЈКэұнҙпКҪЎў»ҜС§ЖҪәвіЈКэУлЖҪәвЧӘ»ҜВКөДјЖЛгөИЎЈ


 МмМмПтЙПТ»ұҫәГҫнПөБРҙр°ё
МмМмПтЙПТ»ұҫәГҫнПөБРҙр°ё РЎС§Йъ10·ЦЦУУҰУГМвПөБРҙр°ё
РЎС§Йъ10·ЦЦУУҰУГМвПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәОКҙрМв
ЈЁ16·ЦЈ©ҙуЖшЦРөДІҝ·ЦөвФҙУЪO3¶ФәЈЛ®ЦРIЈӯөДСх»ҜЎЈҪ«O3іЦРшНЁИлNaIИЬТәЦРҪшРРДЈДвСРҫҝЎЈ
ЈЁ1Ј©O3Ҫ«IЈӯСх»ҜіЙI2өД№эіМУЙ3ІҪ·ҙУҰЧйіЙЈә
ўЩIЈӯ(aq)+ O3(g)==IOЈӯ(aq)+O2(g) ЎчH1
ўЪIOЈӯ(aq)+H+(aq)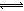 HOI(aq) ЎчH2
HOI(aq) ЎчH2
ўЫHOI(aq)+ IЈӯ(aq)+ H+(aq)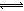 I2(aq)+H2O(l) ЎчH3
I2(aq)+H2O(l) ЎчH3
ЧЬ·ҙУҰөД»ҜС§·ҪіМКҪОӘ______Ј¬Жд·ҙУҰЎчH=______ЎЈ
ЈЁ2Ј©ФЪИЬТәЦРҙжФЪ»ҜС§ЖҪәвЈәI2(aq)+IЈӯ(aq)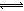 I3Јӯ(aq)Ј¬ЖдЖҪәвіЈКэұнҙпКҪОӘ_______ЎЈ
I3Јӯ(aq)Ј¬ЖдЖҪәвіЈКэұнҙпКҪОӘ_______ЎЈ
ЈЁ3Ј©ОӘМҪҫҝFe2+¶ФСх»ҜIЈӯ·ҙУҰөДУ°ПмЈЁ·ҙУҰМеПөИзНј13Ј©Ј¬ДіСРҫҝРЎЧйІв¶ЁБҪЧйКөСйЦРI3ЈӯЕЁ¶ИәНМеПөpHЈ¬Ҫб№ыјыНј14әНПВұнЎЈ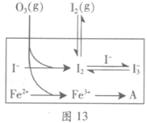
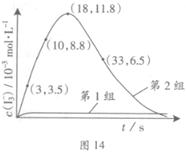
| ұаәЕ | ·ҙУҰОп | ·ҙУҰЗ°pH | ·ҙУҰәуpH |
| өЪ1Чй | O3+ IЈӯ | 5.2 | 11.0 |
| өЪ2Чй | O3+ IЈӯ+ Fe2+ | 5.2 | 4.1 |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәјЖЛгМв
Т»¶ЁМхјюПВЈ¬ҝЙДж·ҙУҰЈәA2+B2 2CҙпөҪЖҪәвЎЈҫӯІв¶ЁЈ¬ЖҪәвКұc(A2)=0.5mol/LЈ¬c(B2)=0.1mol/LЈ¬c(C)=1.6mol/LЈ¬ИфA2ЎўB2әНCөДЖрКјЕЁ¶И·ЦұрОӘamol/LЈ¬bmol/LЈ¬cmol/LЎЈ
2CҙпөҪЖҪәвЎЈҫӯІв¶ЁЈ¬ЖҪәвКұc(A2)=0.5mol/LЈ¬c(B2)=0.1mol/LЈ¬c(C)=1.6mol/LЈ¬ИфA2ЎўB2әНCөДЖрКјЕЁ¶И·ЦұрОӘamol/LЈ¬bmol/LЈ¬cmol/LЎЈ
Зл»ШҙрЈә
ЈЁ1Ј©aЎўbУҰВъЧгөД№ШПөКЗ ЈЁ2Ј©aөДИЎЦө·¶О§КЗ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәјЖЛгМв
°ҙТӘЗуНкіЙПВБРёчРЎМвЎЈ
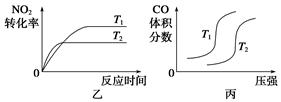
ўсЎўCOәНH2өД»мәПЖшМеЛЧіЖәПіЙЖшЈ¬КЗТ»ЦЦЦШТӘөД№ӨТөФӯБПЖшЈ¬Ҫ№МҝЎўМмИ»ЖшЈЁЦчТӘіЙ·ЦОӘCH4Ј©ЎўЦШУНЎўГәФЪёЯОВПВҫщҝЙУлЛ®ХфЖш·ҙУҰЦЖөГәПіЙЖшЎЈ
ЈЁ1Ј©ТСЦӘДі·ҙУҰөДЖҪәвіЈКэұнҙпКҪОӘЈә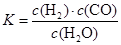
ЛьЛщ¶ФУҰөД»ҜС§·ҪіМКҪОӘЈә ЎЈ
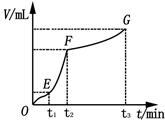
ЈЁ2Ј©ПтМе»эОӘ2LөДГЬұХИЭЖчЦРідИлCH4әНH2O(g)ЧйіЙөД»мәПЖшЈЁ№І1molЈ©Ј¬ФЪТ»¶ЁМхјюПВ·ўЙъ·ҙУҰЈ¬ІўҙпөҪЖҪәвЧҙМ¬Ј¬ІвөГОВ¶ИЎўС№ЗҝЎўН¶БПұИXЎІn(CH4)/n(H2O)Ўі¶ФёГ·ҙУҰөДУ°ПмИзНјЛщКҫЎЈ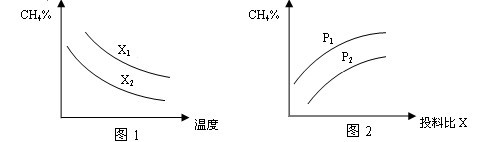
ўЩНј1ЦРөДБҪМхЗъПЯЛщКҫН¶БПұИөД№ШПөX2 ____ X1(МоЎ°=ЎұЎ°>Ўұ»тЎ°<ЎұПВН¬)
ўЪНј2ЦРБҪМхЗъПЯЛщКҫөДС№ЗҝұИөД№ШПөЈәP2 _______P1
ЈЁ3Ј©ТФCH4ЎўO2ОӘФӯБПҝЙЙијЖіЙИјБПөзіШЈә
ўЩЙиЧ°ЦГЦРКўУР150.0mL 1.0mol/L KOHИЬТәЈ¬·ЕөзКұІОУл·ҙУҰөДСхЖшФЪұкЧјЧҙҝцПВөДМе»эОӘ4.48LЈ¬јЩЙи·Еөз№эіМЦРГ»УРЖшМеТЭіцЈ¬Фт·ЕөзНкұПәуЈ¬ЛщөГИЬТәЦРёчАлЧУЕЁ¶ИУЙҙуөҪРЎөД№ШПөОӘЈә
ўЪТФH2SO4ИЬТәҙъМжKOHИЬТәОӘөзҪвЦКИЬТә,Ҫ«CH4ёДОӘC6H12O6 Ј¬ФтИјБПөзіШөДёәј«·ҙУҰКҪОӘЈә
ЎЈ
ўтЎўЈЁ1Ј©ДіОВ¶И(tЎж)КұЈ¬ІвөГ0.01molЎӨL-1өДNaOHИЬТәөДpHЈҪ11ЎЈФЪҙЛОВ¶ИПВЈ¬Ҫ«pHЈҪ2өДH2SO4ИЬТәVaLУлpHЈҪ12өДNaOHИЬТәVbL»мәПЈ¬ИфЛщөГ»мәПТәОӘЦРРФЈ¬ФтVa©UVbЈҪ ЎЈ
(2)ФЪ25ЎжКұЈ¬Ҫ«c molЎӨL-1өДҙЧЛбИЬТәУл0.02 molЎӨL-1NaOHИЬТәөИМе»э»мәПәуИЬТәёХәГіКЦРРФЈ¬УГә¬cөДҙъКэКҪұнКҫCH3COOHөДөзАліЈКэKa=____________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәјЖЛгМв
ДіРЎЧйАыУГH2C2O4ИЬТәәНЛбРФKMnO4ИЬТә·ҙУҰАҙМҪҫҝЎ°Мхјю¶Ф»ҜС§·ҙУҰЛЩВКөДУ°ПмЎұЎЈКөСйКұЈ¬ПИ·ЦұрБҝИЎБҪЦЦИЬТәЈ¬И»әуө№ИлКФ№ЬЦРСёЛЩХсөҙ»мәПҫщФИЈ¬ҝӘКјјЖКұЈ¬НЁ№эІв¶ЁНКЙ«ЛщРиКұјдАҙЕР¶П·ҙУҰөДҝмВэЎЈёГРЎЧйЙијЖБЛИзПВөД·Ҫ°ёЎЈ
| ұаәЕ | H2C2O4ИЬТә | ЛбРФKMnO4ИЬТә | ОВ¶И/Ўж | ||
| ЕЁ¶И/ mol?LЈӯ1 | Ме»э/mL | ЕЁ¶И/ mol?LЈӯ1 | Ме»э/mL | ||
| ўЩ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ўЪ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ўЫ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |

Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәКөСйМв
(15·Ц)ТТҙјКЗЦШТӘөДУР»ъ»Ҝ№ӨФӯБПЈ¬ҝЙУЙТТП©ЦұҪУЛ®әП·Ё»тјдҪУЛ®әП·ЁЙъІъЎЈ»ШҙрПВБРОКМвЈә
ЈЁ1Ј©јдҪУЛ®әП·ЁКЗЦёПИҪ«ТТП©УлЕЁБтЛб·ҙУҰЙъіЙБтЛбЗвТТхҘ(C2H5OSO3H)ЎЈФЩЛ®ҪвЙъіЙТТҙјЎЈРҙіцПаУҰөД·ҙУҰөД»ҜС§·ҪіМКҪ
ЈЁ2Ј©ТСЦӘЈә
јЧҙјНСЛ®·ҙУҰўЩ2CH3OH(g)ЈҪCH3OCH3(g)Ј«H2O(g)?ЎчH1ЈҪЈӯ23.9KJЎӨmolЈӯ1
јЧҙјЦЖП©Мю·ҙУҰўЪ2CH3OH(g)ЈҪC2H4 (g)Ј«2H2O(g)? ЎчH2ЈҪЈӯ29.1KJЎӨmolЈӯ1
ТТҙјТм№№»Ҝ·ҙУҰўЫCH3CH2OH(g)ЈҪCH3OCH3(g))? ЎчH3ЈҪ+50.7KJЎӨmolЈӯ1
ФтТТП©ЖшПаЦұҪУЛ®әП·ҙУҰC2H4 (g)Ј«H2O(g)ЈҪC2H5OH(g)өД?ЎчHЈҪ KJЎӨmolЈӯ1
УлјдҪУЛ®әП·ЁПаұИЈ¬ЖшПаЦұҪУЛ®әП·ЁөДУЕөгКЗЈә ЎЈ
ЈЁ3Ј©ПВНјОӘЖшПаЦұҪУЛ®әП·ЁЦРТТП©өДЖҪәвЧӘ»ҜВКУлОВ¶ИЎўС№ЗҝөД№ШПө(ЖдЦРn(H2O)©Un(C2H4)=1©U1)
ўЩБРКҪјЖЛгТТП©Л®әПЦЖТТҙј·ҙУҰФЪНјЦРAөгөДЖҪәвіЈКэKЈҪ (УГЖҪәв·ЦС№ҙъМжЖҪәвЕЁ¶ИјЖЛгЈ¬·ЦС№ЈҪЧЬС№ЎБОпЦКөДБҝ·ЦКэ)
ўЪНјЦРС№ЗҝP1ЎўP2ЎўP3ЎўP4өДҙуРЎЛіРтОӘЈә Ј¬АнУЙКЗЈә
ўЫЖшПаЦұҪУЛ®әП·ЁөіІЙУГөД№ӨТХМхјюОӘЈәБЧЛб/№иФеНБОӘҙЯ»ҜјБЈ¬·ҙУҰОВ¶И290 ЎжЈ¬С№Зҝ6Ј®9MPaЈ¬n(H2O)©Un(C2H4)=0Ј®6©U1ЎЈТТП©өДЧӘ»ҜВКОӘ5ЁGЎЈИфТӘҪшТ»ІҪМбёЯТТП©өДЧӘ»ҜВКЈ¬іэБЛҝЙТФККөұёДұд·ҙУҰОВ¶ИәНС№ЗҝНвЈ¬»№ҝЙТФІЙИЎөДҙлК©УРЈә Ўў ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәКөСйМв
ЈЁ7·ЦЈ©ОӘБЛСРҫҝНвҪзМхјю¶Ф№эСх»ҜЗв·ЦҪвЛЩВКөДУ°ПмЈ¬ДіН¬С§ЧцБЛТФПВКөСйЈә
| ұаәЕ | ІЩЧч | КөСйПЦПу |
| ўЩ | ·ЦұрФЪКФ№ЬAЎўBЦРјУИл5 mL 5% H2O2ИЬТәЈ¬ёчөОИл2өО1 molЎӨLЈӯ1 FeCl3ИЬТәЎЈҙэКФ№ЬЦРҫщУРККБҝЖшЕЭіцПЦКұЈ¬Ҫ«КФ№ЬA·ЕИлКўУР5ЎжЧуУТАдЛ®өДЙХұӯЦРҪюЕЭЈ»Ҫ«КФ№ЬB·ЕИлКўУР40ЎжЧуУТИИЛ®өДЙХұӯЦРҪюЕЭ | КФ№ЬAЦРОЮГчПФЖшЕЭІъЙъЈ» КФ№ЬBЦРІъЙъөДЖшЕЭБҝФцјУ |
| ўЪ | БнИЎБҪЦ§КФ№Ь·ЦұрјУИл5 mL 5% H2O2ИЬТәәН5 mL 10% H2O2ИЬТә | КФ№ЬAЎўBЦРҫщОҙГчПФјыөҪУРЖшЕЭІъЙъ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәКөСйМв
Ді»ҜС§РЛИӨРЎЧйФЪТ»ҙОКөСйМҪҫҝЦР·ўПЦЈ¬ПтІЭЛбИЬТәЦРЦрөОјУИлёЯГМЛбјШИЬТәКұЈ¬ИЬТәНКЙ«ПИВэәуҝмЈ¬јҙ·ҙУҰЛЩВКУЙРЎұдҙуЎЈРЎЧйіЙФұОӘҙЛЎ°ТміЈЎұПЦПуХ№ҝӘМЦВЫЈ¬ІВПлФміЙХвЦЦПЦПуөДЧоҝЙДЬФӯТтУРБҪЦЦЈ¬ІўОӘҙЛЙијЖКөСйҪшРРМҪҫҝСйЦӨЎЈ
ІВПлўсЈәҙЛ·ҙУҰ№эіМ·ЕИИЈ¬ОВ¶ИЙэёЯЈ¬·ҙУҰЛЩВКјУҝмЈ»
ІВПлўтЈәЎӯЎӯЎЈ
ЎҫКөСйДҝөДЎҝМҪҫҝІЭЛбУлёЯГМЛбјШ·ҙУҰөДЛЩВКұд»ҜЎ°ТміЈЎұФӯТт
ЎҫКөСйУГЖ·ЎҝТЗЖчЈәКФ№ЬЎўҪәН·өО№ЬЎўБҝНІЎўТ©іЧЎўІЈБ§°фөИЈ»
КФјБЈә0.1mol/L H2C2O4ИЬТәЎў0.05mol/L KMnO4ЈЁБтЛбЛб»ҜЈ©ИЬТәөИЎЈ
ЗлДгёщҫЭёГРЛИӨРЎЧйөДКөСйМҪҫҝЙијЖЛјВ·Ј¬І№ідНкХыЛщИұДЪИЭЎЈ
ЈЁ1Ј©ІЭЛбЈЁH2C2O4Ј¬ИхЛбЈ©УлЛбРФKMnO4ИЬТә·ҙУҰөДАлЧУ·ҪіМКҪОӘЈЁТСЦӘЈәMnO4ЈЯ»№ФӯІъОпКЗMn2+Ј© ЎЈ
ЈЁ2Ј©ТӘНкіЙ¶ФІВПлўсөДКөСйСйЦӨЈ¬ЦБЙЩ»№РиТӘТ»ЦЦКөСйТЗЖчКЗ ЎЈ
ЈЁ3Ј©ІВПлўтҝЙДЬКЗ______________________________________________________________ЎЈТӘЙијЖКөСйСйЦӨІВПлўтЈ¬ҪшРРёГКөСй»№ТӘІ№ідТ»ЦЦКФјБј°Т»ЦЦТЗЖчЈ¬·ЦұрКЗ ЎЈ
ЈЁ4Ј©»щУЪІВПлўтіЙБўЈ¬ЙијЖ·Ҫ°ёҪшРРКөСйЈ¬ЗлНкіЙТФПВКөСйјЗВјұнДЪИЭЎЈ
| | КФ№ЬA | КФ№ЬB |
| јУИлКФјБ | | |
| ЈЁФӨЖЪЈ©КөСйПЦПу ЈЁНКЙ«КұјдЈ© | | |
| ҪбВЫ | ІВПлўтХэИ· | |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈәөҘСЎМв
ПВБРУР№ШЦРәНөО¶ЁөДІЩЧчЈәўЩУГұкЧјТәИуПҙөО¶Ё№ЬЈ»ўЪНщөО¶Ё№ЬДЪЧўИлұкЧјИЬТәЈ»ўЫјмІйөО¶Ё№ЬКЗ·сВ©Л®Ј»ўЬөО¶ЁЈ»ўЭөОјУЦёКҫјБУЪҙэІвТәЈ»ўЮПҙөУЎЈХэИ·өДІЩЧчЛіРтКЗ
| AЈ®ўЮўЫўЩўЪўЭўЬ | BЈ®ўЭўЩўЪўЮўЬўЫ | CЈ®ўЭўЬўЫўЪўЩўЮ | DЈ®ўЫўЩўЪўЬўЭўЮ |
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com