
����Ŀ����ͭ�Ͻ�㷺���ں��չ�ҵ�����и�����л��������Ʊ�ͭ������Ʒ�Ĺ������£�
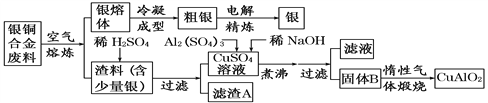
[ע��Al(OH)3��Cu(OH)2 ��ʼ�ֽ���¶ȷֱ�Ϊ450���80��]
��1������A��ϡHNO3��Ӧ�������������ڿ�����Ѹ�ٱ�Ϊ����ɫ���������ɫ�Ļ�ѧ��Ӧ����ʽΪ_________________��
��2����������B�����Ϊ__________��__________��
��3��������չ�����һ����Ӧ�Ļ�ѧ����ʽ��__________________________________����
��4������ͭ�Ͻ���ͭ����������Ϊ64.0%��������5.0kg�����е�ͭ����ȫת��ΪCuAlO2��������Ҫ1.0 mol��L��1��Al2(SO4)3��Һ________L��
��5��CuSO4��ҺҲ�������Ʊ������������������___________��__________�����ˡ�ϴ�Ӻ��
���𰸡� 2NO��O2==2NO2 CuO Al(OH)3 4��2��4��O2 25 ����Ũ�� ��ȴ�ᾧ
��������(1)��ɫ��NO�ڳ�����������е�O2Ѹ�ٻ������ɺ���ɫN02��������ӦΪ2NO+O2=2NO2��
(2)δ���֮ǰ��Cu(OH)2��Al(OH)3��Al(OH)3��Cu(OH)2��ʼ�ֽ���¶ȷֱ�Ϊ450���80�棬��к�Cu(OH)2�ֽ��������ͭ����֪BΪAl(OH)3��CuO��
(3)���չ�����CuO��Al2O3�����·�Ӧ����CuAlO2��O2����ӦǰCuΪ+2�ۣ���Ӧ��Ϊ+1�����ϼ۽���1��Al���ϼ�û�б仯��������Ԫ�صĻ��ϼ����ߣ�������������Ӧǰ��Ϊ-2�ۣ���Ӧ��Ϊ0�����ϼ�����2�����ߵ���С��������2���ٸ���ԭ���غ��4CuO+2Al2O3=4CuAlO2+O2����
(4)�ɹ�ϵʽ��Cu��CuAlO2��n(CuAlO2)= ![]() =50.0mol����CuAlO2Ϊ50.0mol��
=50.0mol����CuAlO2Ϊ50.0mol��
�ɹ�ϵʽ��Al2(SO4)3��2CuAlO2��Al2(SO4)3=n(CuAlO2)��![]() =25.0mol��������Ҫ���Ϊ
=25.0mol��������Ҫ���Ϊ![]() =25.0L��
=25.0L��
(5)��CuSO4��Һ���CuSO45H2O���壬��Ҫ��������Ũ������ȴ�ᾧ(��ᾧ)�����˵Ȳ�����


 �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д� ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ̼����л��е������Ȼ��ƹ��壬��ˮ����Ҫ��ȡ�IJ����ǣ� ��
A.��ȡB.����C.����D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˵���ǽ�����Cl��S���ǣ� ��
�ٴﵽ�ȶ��ṹʱ����ԭ��ֻ��Ҫ1�����ӣ�����ԭ����Ҫ2������
���ȵĺ��������ĺ����������ǿ�ۻ�ԭ��S2����Cl��
���ȶ���HCl��H2S������HCl��H2S��H2S+Cl2=S��+2HCl
��2Fe+3Cl2 ![]() 2FeCl3Fe+S
2FeCl3Fe+S ![]() FeS
FeS
��Cl2��H2�ڹ��ջ��ȼ�·�Ӧ��������H2�����²ŷ�Ӧ��
A.ȫ��
B.�ڢۢܢ�
C.�ۢܢޢߢ�
D.�ۢܢݢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Cl2ͨ��һ��Ũ�ȵĿ��Լ���Һ�У�����ǡ����ȫ��Ӧ(��֪��Ӧ���̷���)���������������ֺ���Ԫ�ص����ӣ�����ClO����ClO3���������ӵ����ʵ���(n)�뷴Ӧʱ��(t)�ı仯ʾ��ͼ��ͼ��ʾ������˵������ȷ����(����)

A. ��Ӧ��ת�Ƶ��ӵ����ʵ�����0.21mol
B. һ����3. 36L�����μӷ�Ӧ
C. ���Լ���Һ��KOH��������16.8g
D. ClO�����ɿ����������¶����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ����Fe3+��Mg2+��Fe2+��Al3+���������ӣ��������м������������������Һ��������ټ�����������ᣬ��Һ�д������ٵ���������
A.Fe2+B.Mg2+C.Fe3+D.Al3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����������ת�����Իش���

��1��д��B�Ļ�ѧʽ_________________��
��2��д����Eת���F�Ļ�ѧ����ʽ_____________________________________��
��3��д����KSCN����G��Һ�����ӷ���ʽ__________________________________�� ��G��Һ����A�����ӷ���ʽ_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10.0mL0.10mol/L��ˮ�е���0.10mol/L�����ᣬ��Һ��pH����������������ϵ��ͼ��ʾ�������������ݳ����������й�������ȷ����

A. M��N��һ�����ڣ�c(Cl-)>c(NH4+)>c(OH-)>c(H+) B. M���Ӧ���������Ϊ10.0mL
C. M��N������ʾ��Һ��ˮ�ĵ���̶���ͬ D. P�㴦����Һ�д���2c(NH4+)+2c(NH3��H2O)=c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¶��£���2 mol SO2��1mol O2����10 L�����ܱ������У�������Ӧ2SO2(g) +O2(g)![]() 2SO3(g) ��H =-196 kJ mol-1��5 minʱ�ﵽƽ�⣬��÷�Ӧ����166. 6 kJ������˵���������
2SO3(g) ��H =-196 kJ mol-1��5 minʱ�ﵽƽ�⣬��÷�Ӧ����166. 6 kJ������˵���������
A. 0��5 min�ڣ���O2��ʾ��ƽ����Ӧ����V(O2)=0.017 mol��L-1��min-1
B. ![]() ��ֵ����ʱ���÷�Ӧ�ﵽƽ��״̬
��ֵ����ʱ���÷�Ӧ�ﵽƽ��״̬
C. ������O2��Ũ�ȣ�SO2��ת��������
D. �������䣬����ʼʱ����4 mol SO2��2 mol O2��ƽ��ʱ�ų�������С��333.2 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s) ��H= - 444.3kJ/mol���ڳ��³�ѹ�����Է����У��Է�Ӧ�ķ�������������õ���
A. �ʱ� B. �¶� C. ѹǿ D. �ر�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com