
【题目】下列叙述不正确的是 ( )
A.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
B.硝酸不稳定,受热或光照易分解
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D.Cl2能与金属活动顺序表中大多数金属反应
科目:高中化学 来源: 题型:
【题目】某校合作学习小组的同学设计实验验证Na2SO4与焦炭高温加热后的产物。回答下列问题。
(1)Na2SO4与焦炭反应的实验装置如下图所示:
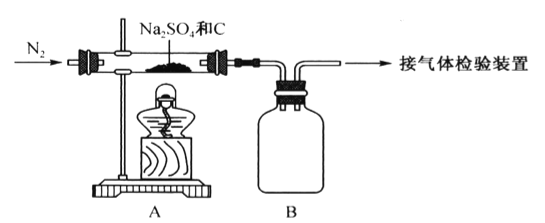
①先通入N2,然后加热,直至反应结束,整个过程中N2的作用是__________________________。
②装置B的作用是___________。
(2)该同学认为气体产物中可能含有CO2、CO 及SO2,并进行验证,选用上述实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
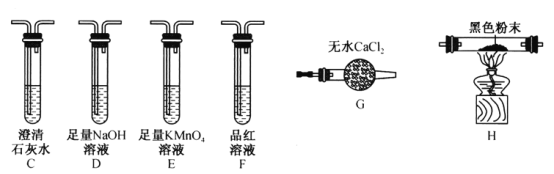
①实验装置连接的合理顺序为A、B、___________。装置H中黑色粉末是___________。
②能证明产物中有CO的现象是____________________________________________。
③若含有SO2,E装置的作用是______________________________(用化学方程式说明)。
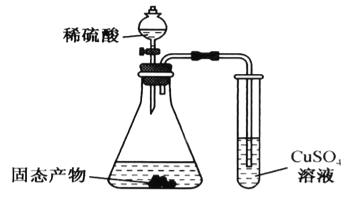
(3)某同学利用下图装置验证固态产物,能证明固态产物中含有Na2S的现象是___________。若实验中发现固态产物完全反应后,锥形瓶底部还产生少量黄色沉淀,说明固体产物中除含有Na2S外,还含有少量的___________(填一种可能的物质)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用惰性电极电解200 mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。

(1)下列说法正确的是______(填序号)。
A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.a电极上发生的反应为2H++2e-==H2↑和4OH--4e-==2H2O+O2↑
C.从P点到Q点时收集到的混合气体的平均摩尔质量为12 g·mol-1
D.OP段表示H2和O2混合气体的体积变化,PQ段表示O2的体积变化
(2)如果向所得的溶液中加入0.1 mol Cu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为________mol。
(3)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为________mol。
Ⅱ. 金属腐蚀是我们日常生活的常见现象(如图所示)。

(1)如图铜板上铁铆钉处的腐蚀属于____腐蚀。
(2)分析此腐蚀过程,下列有关说法中,不正确的是____。
A.正极电极反应式为:2H++2e-=H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C8H18经多步裂化,最后完全转化为C4H8、C3H6、C2H4、C2H6、CH4五种气体的混合物.该混合物的平均相对分子质量可能是( )
A.28
B.30
C.38
D.40
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某城市某日空气质量报告,下列叙述与报告内容不相符的是

A. 该日空气首要污染物是PM10
B. 该日空气质量等级属于中度污染
C. 污染物NO2、CO可能主要来源于机动车尾气
D. PM2.5、PM10指的是悬浮颗粒物,会影响人体健康
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生如下转化:

(1)乙烯的结构简式是________。
(2)乙酸乙酯中的官能团是________。
(3)③的反应类型是________。
(4)②的化学反应方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2L的密闭容器中,将2molL 气体和3molM 气体混合,发生如下反应:2L(g)+3M(g)═xQ(g)+3R(g),10s末,生成2.4molR,并测得Q的浓度为0.4molL﹣1 . 计算:
(1)10s末L的物质的量浓度为 .
(2)前10s内用M表示的化学反应速率为 .
(3)化学方程式中x值为 .
(4)在恒温恒容条件,往容器中加入1mol氦气,反应速率(增大、减小、不变)
(5)在恒温恒压条件,往容器中加入1mol氦气,反应速率(增大、减小、不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO3-、SeO32-三种微粒的物质的量分数与溶液pH 的关系如图所示。下列说法不正确的是

A. 常温下,亚硒酸的电离平衡常数K2=10-4.2
B. pH=l.2的溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SeO3)
C. 将相同物质的量NaHSeO3和Na2SeO3 固体完全溶于水可配得pH为4.2的混合液
D. 向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com