
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(烃基自由基)。下列说法错误的是
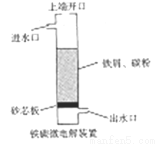
A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e-=H·
C. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
科目:高中化学 来源:南开中学2016-2017高三第四次月考理综化学试卷 题型:选择题
下列实验操作或事实与预期实验目的或所得结论一致的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含有FeCl3 |
B | Br2 | 制备少量KBr溶液 |
C | 无色试液 | 说明原溶液中一定不含钾元素 |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于三元酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师范大学附属中学高一3月月考化学试卷(解析版) 题型:选择题
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源:2017届河北省石家庄市高三下学期模拟联考理科综合化学试卷(解析版) 题型:选择题
实验测得pH=1.0的某溶液中还可能大量存在:Na+、Fe2+、Al3+、NH4+、SO42-、Cl-中的若干种离子,现进行了如下实验:
步骤I. 取该溶液10.0mL,加入过量1.0mol/LBa(NO3)2溶液,产生白色沉淀A和无色气体B,B遇空气立即变为红棕色:
步骤II. 向I所得的溶液中加入过量1.0mol/LNaOH溶液,有红褐色沉淀C和无色刺激性气体D生成。用铂丝蘸取所得溶液,在火焰上灼烧,火焰呈黄色;
步骤III. 向II所得的溶液中通入过量CO2有沉淀E生成。下列推断错误的是( )
A. 步骤I中白色沉淀A的化学式为BaSO4
B. 步骤Ⅱ中产生沉淀C的反应:Fe3+ + 3OH-=Fe(OH)3↓
C. CO2先后分别与 NaOH(aq)、NaAlO2(aq)反应
D. 原溶液一定含有:Na+、Fe2+、Al3+、SO42-
查看答案和解析>>
科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:推断题
[化学-选修5:有机化学基础]
甲苯在医药、农药,特别是香料合成中应用广泛,可合成以下物质:
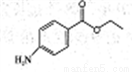

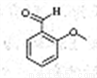
苯佐卡因 乙基香草醛 邻茴香醛
(1)苯佐卡因中含有的碱性官能团为____________(填名称)。
(2)乙基香草醛和邻茴香醛具有相同的亲水基团,该基团可用________(填物理方法)检测。
(3)写出符合下列条件的乙基香草醛的同分异构体的结构简式______(任写两种)。
a.苯环上连接两个互为对位的基团 b.有一个-CH3
c.与FeCl3溶液发生显色反应 d.能发生水解反应
(4)已知:
有机物M为含有两个互为邻位基团的芳香族化合物,且与本佐卡因互为同分异构,其合成路线如下:
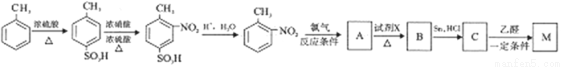
①生成A的“反应条件”为________;
②以上合成路线涉及的7个反应中,属于取代反应的有_________个;
③M的结构简式为___________;
④A→B反应的化学方程式为____________。
(5)参照上述合成路线,以甲苯和甲醇为原料(无机试剂任选),设计制备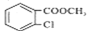 的合成路线___________。
的合成路线___________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:选择题
设NA为阿伏加徳罗常数的值。下列有关叙述正确的是
A. .25℃时,1LpH =11的氨水中OH-为0.001 NA
B. 标准状况下,2.24 L SO3的氧原子数为0.3NA
C. 4.6 g乙醇中含有的共价键数为0. 7NA
D. 3.6gD2O所含质子数为2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:选择题
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—)
B. 实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
C. 实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:选择题
已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源:2017届四川省南充市高三第二次高考适应性考试理综化学试卷(解析版) 题型:填空题
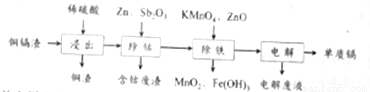
利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:已知铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③______等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式_________。
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3等形成微电池产生合金CoSb。该微电池的正极反应式为___________。
(3)除铁的过程分两步进行,①加入适量KMnO4,发生反应的离子方程式为___________,②加入ZnO控制反应液的pH范围为___________。
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是______,若加入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证__________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是__________。
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com