
下列条件中,可以判断An+比Bm+的氧化性强的是( )
A.mAn++nB=mA+nBm+
B.mAn++C=mA+Cmn+, nBm++C=nB+Cmn+(催化剂)
C.A、B为同周期元素,其最高正价分别是+n、+m,且m>n
D.A、B为同主族元素,n=m为最高正价,原子序数A>B
科目:高中化学 来源: 题型:

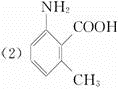

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:走向清华北大同步导读·高一化学 题型:013
有下列三种制取氯气的方法:①实验室用二氧化锰跟浓盐酸反应制取氯气;②KMnO4是一种常用的氧化剂.在酸性条件下,可用高锰酸钾跟浓盐酸在室温下制氯气,其中![]() 被还原成Mn2+;③历史上曾用“地康法”制氯气,是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.比较以上三个反应,下列说法不正确的是
被还原成Mn2+;③历史上曾用“地康法”制氯气,是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.比较以上三个反应,下列说法不正确的是
[ ]
A.三个反应中,HCl均是还原剂,Cl2为氧化产物
B.三个反应中,可以判断氧化能力从强到弱顺序为KMnO4>MnO2>O2
C.用三种方法制取1mol氯气,转移电子数目相等
D.等物质的量的二氧化锰、高锰酸钾、氧气与足量HCl反应,生成Cl2的物质的量相等
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:021
A.mAn++nB=mA+nBm+
B.mAn++C=mA+Cmn+, nBm++C=nB+Cmn+(催化剂)
C.A、B为同周期元素,其最高正价分别是+n、+m,且m>n
D.A、B为同主族元素,n=m为最高正价,原子序数A>B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com