
【题目】下列叙述中,错误的是
A. 阿伏加德罗常数的符号为NA,其近似值为6.02×1023 mol-1
B. 等物质的量的O2与O3,所含氧原子数相同
C. 在0.5 mol Na2SO4中,含有的Na+数约是6.02×1023
D. 摩尔是物质的量的单位
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用Fe2O3与CO反应来制取单质Fe。
(1)请按气流由左到右的方向连接下列各装置,顺序为A→____→____ →____ →____ 。___________
(2)检查装置A气密性的方法是____________________。
(3)在点燃B处的酒精灯前,应进行的操作是_______。
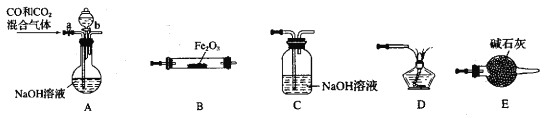
(4)若用100mL0.1molL的NaOH 溶液吸收224mLCO2气体(标准状况),恰好完全吸收。再将所得溶液加入100mL0.1mol/L氢氧化钙溶液中。请写出所得溶液与氢氧化钙溶液反应的离子方程式:________________。
(5)配制100mL 0.1mol/LNaOH 溶液时,下列操作会导致所配溶液浓度偏高的操作是______。A.容量瓶用蒸馏水洗涤后未进行干燥处理,底部有少量水残留。
B.用蒸馏水溶解氢氧化钠固体后,立即转移到容量瓶中,然后洗涤、定容。
C.定容摇匀后,发现液面低于刻度线,又加水到刻度线位置
D.定容时仰视刻度线
E.称量氢氧化钠固体时所用砝码生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法中,错误的是( )
A. 振荡试管中的液体时,应用手指拿住试管,左右摆动手腕振荡试管
B. 在做蒸馏实验时要加入少量的碎瓷片,以防止溶液暴沸
C. 如果皮肤上不慎沾上浓硫酸,应立即用大量的NaOH稀溶液冲洗
D. 用石蕊或酚酞试纸进行气体验满时,先用蒸馏水湿润试纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL 0.01molL﹣1 HA溶液中逐滴加入0.02 molL﹣1 MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( ) 
A.HA为一元强酸
B.MOH为一元弱碱
C.N点水的电离程度小于K点水的电离程度
D.K点对应的pH=10,则有c(MOH)+c(OH﹣)﹣c(H+)=0.005molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作中正确的是
A. 稀释浓硫酸时,将浓硫酸沿器壁缓慢注入水中,并不断搅拌
B. 过滤时,漏斗里液体的液面要高于滤纸的边缘
C. 胶头滴管的管口直接伸入试管里滴加液体,以免外溅
D. 实验结束后,用嘴吹灭酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH![]() 、SO
、SO![]() 、CO
、CO![]() 、K+ B. Na+、Ba2+、Ca2+、HCO
、K+ B. Na+、Ba2+、Ca2+、HCO![]()
C. Mg2+、SO![]() 、K+、Cl- D. K+、Cl-、Na+、SO
、K+、Cl- D. K+、Cl-、Na+、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
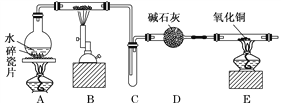
(1)A装置的作用是________________,B中反应的化学方程式为_____________。
(2)D的作用是____________________________________________________________。
(3)E中的现象是__________________________________________________________。
(4)A、B两个装置中应先点燃_______处的酒精灯,点燃E处酒精灯之前应进行的操作是_______________________________________________________________________。
【答案】 产生水蒸气 3Fe+4H2O(g) ![]() Fe3O4+4H2 吸收未反应的水蒸气 黑色固体变为红色,右端管壁有水珠生成 A 收集H2,并检验其纯度
Fe3O4+4H2 吸收未反应的水蒸气 黑色固体变为红色,右端管壁有水珠生成 A 收集H2,并检验其纯度
【解析】(1)铁与水蒸气反应的条件是高温,水的状态是气体,所以A装置的作用是产生水蒸气,B中是铁与水蒸气反应生成氢气和四氧化三铁,方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;(2)生成的氢气中含有水蒸气,则D中碱石灰的作用是吸收未反应的水蒸气;(3)氢气还原氧化铜得到铜和水即H2+CuO
Fe3O4+4H2;(2)生成的氢气中含有水蒸气,则D中碱石灰的作用是吸收未反应的水蒸气;(3)氢气还原氧化铜得到铜和水即H2+CuO![]() Cu+H2O,所以实验现象是硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;(4)若先点燃B处,铁会与氧气先发生反应,所以须先点燃A处;氢气是可燃性气体混有空气会发生爆炸,所以点燃E处酒精灯之前应进行的操作是验证氢气的纯度。
Cu+H2O,所以实验现象是硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;(4)若先点燃B处,铁会与氧气先发生反应,所以须先点燃A处;氢气是可燃性气体混有空气会发生爆炸,所以点燃E处酒精灯之前应进行的操作是验证氢气的纯度。
【题型】实验题
【结束】
20
【题目】某研究性学习小组为研究氯气是否具有漂白性,设计如图所示实验装置。试根据实验装置回答下列问题:
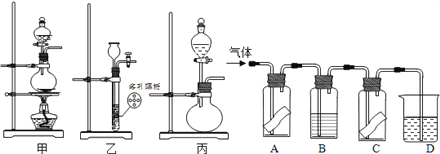
A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液。
(1)在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的_______。
(2)B中的液体为____________,其作用为____________________________________。
(3)A、C中有色布条的颜色变化分别为__________________________________,A、C的实验现象说明氯气是否具有漂白性?________(填“是”或“否”)。
(4)D中NaOH溶液的作用是________________________________________(用离子方程式说明)。
(5)将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去。小组内有甲、乙两种意见:
甲:氯气溶于水后溶液显酸性,中和了NaOH,使溶液褪为无色;
乙:氯气溶于水生成漂白性物质,使溶液褪为无色。
丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则______(填“甲”或“乙”)的意见正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于各图的说法(其中①③④中均为惰性电极)正确的是( )
A.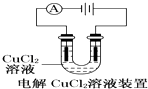
装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝
B.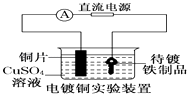
装置中待镀铁制品应与电源正极相连
C.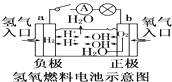
装置中电子由b极流向a极
D.
装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com