
| A. | 1molCa变成Ca2+时失去的电子数为NA | |
| B. | 同温、同压、同体积的CO和NO含有的质子数 | |
| C. | 标准状况下22.4L以任意比例混合的氢气和氧气所含分子总数均为NA | |
| D. | 常温常压下,16g氧气和臭氧(O3)的混合气体中含有NA个氧原子 |
分析 A、钙反应后变为钙离子时失去2个电子;
B、同温同压同体积的CO和NO的物质的量相同,而CO中含14个质子,NO中含15个质子;
C、求出混合气体的物质的量,然后根据分子个数N=nNA来计算;
D、氧气和臭氧均由氧原子构成.
解答 解:A、钙反应后变为钙离子时失去2个电子,故1mol钙变为钙离子时失去2NA个电子,故A错误;
B、同温同压同体积的CO和NO的物质的量相同,而CO中含14个质子,NO中含15个质子,故等物质的量的CO和NO中含有的质子数不同,故B错误;
C、标况下22.4L混合气体的物质的量为1mol,故分子个数N=nNA=NA个,故C正确;
D、氧气和臭氧均由氧原子构成,故16g混合气体中含有的氧原子的物质的量为1mol,故含NA个,故D正确.
故选AB.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 减少C或D的物质的量 | B. | 体积不变充入氦气 | ||
| C. | 减少B的物质的量 | D. | 增大A或B的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44g CO2中含有2NA个π键 | |
| B. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| C. | 0.5mol Cu和足量浓硝酸反应可以生成22.4LNO2 | |
| D. | 过量的液溴与铁反应,若反应中消耗1mol铁,则转移的电子数目为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国目前使用的主要能源仍是化石燃料,它属于不可再生能源 | |
| B. | 太阳能、氢能、风能、地热能、生物质能、沼气能等属于新能源 | |
| C. | 解决能源危机的根本途径是尽可能地节约能源,减少浪费 | |
| D. | 风能是太阳能的一种转换形式,所以风能属于二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应容器内的压强不随时间改变 | |
| B. | 反应容器内P、Q、R、S四者共存 | |
| C. | P的生成速率和S的生成速率相等 | |
| D. | 反应容器内的气体总物质的量不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L NH3所含的原子数为2NA | |
| B. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L H2中所含原子数为NA | |
| D. | 标准状况下,22.4L H2O中所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠溶液显碱性:SO32-+2H2O=H2SO3+2OH- | |
| B. | (NH4)2FeSO4溶液与过量NaOH溶液混合制取氢氧化亚铁:Fe2++2OH-=Fe(OH)2 | |
| C. | NaAlO2溶液中通入过量CO2制取氢氧化铝:2AlO2-+CO2+3H2O=2Al(OH)3+CO32- | |
| D. | 铁红溶于HI酸溶液:Fe2O3+6H++2I-=2Fe2++I2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
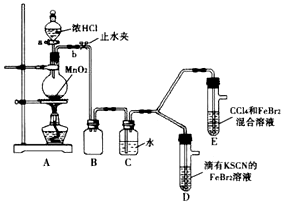
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适置浓盐酸,然后关闭活塞a,点燃酒精灯 | D装罝中:溶液变红,E装置中:水层溶液变黄,振荡后CCl4层无明显变化 | Cl2、Br2、Fe2+的氧化性由强到弱的顺序为Cl2>Br2>Fe3+ |
| i.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2 ii.Cl2和Br2反应生成BrCl,它呈红色(略带黄色)沸点约为5℃,与水发生水解反应 iii.AgClO、AgBrO均可溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com