
【题目】某同学用某种粗盐进行提纯实验,步骤如图所示。

请回答下列问题:
(1)步骤①和②的操作名称是_______________。
(2)进行蒸发操作时,所需仪器除带铁圈的铁架台外,还需用到蒸发皿、________和________(不考虑顺序)。当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含碳酸盐 | 取少量固体A于试管中,滴加稀盐酸,并用内壁涂有澄清石灰水的小烧杯罩住试管口 | ___________ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴加________,再滴加Na2SO4溶液 | 有气泡冒出,无白色沉淀 | 猜想II成立 |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中溶解,__________ | _________ | 猜想Ⅲ成立 |
【答案】过滤 玻璃棒 酒精灯 停止加热 有气泡放出,澄清石灰水变浑浊 稀盐酸 滴入稀盐酸和BaCl2溶液 有白色沉淀
【解析】
由流程可知,粗盐溶于水,①为过滤分离出泥沙,滤液1中加碳酸钠,②为过滤分离出沉淀A为碳酸钙,滤液2含碳酸钠、氯化钠,加盐酸后蒸发得到NaCl,以此来解答。
(1)粗盐提纯步骤为:溶解→过滤→蒸发结晶,步骤①和②是将不溶于液体的固体和液体分离,操作方法都是过滤,故答案为:过滤;
(2)进行蒸发操作时,所需仪器除带铁圈的铁架台外,还需用到蒸发皿、酒精灯和玻璃棒;当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。故答案为:玻璃棒;酒精灯;停止加热;
(3)猜想I中固体与盐酸反应生成二氧化碳,观察到的现象为有气泡放出,澄清石灰水变浑浊,则猜想I成立;猜想Ⅱ中固体与稀盐酸反应生成气体,再加硫酸钠无白色沉淀,则猜想Ⅱ成立;猜想Ⅲ中固体溶于水,滴入稀盐酸和BaCl2溶液,观察到有白色沉淀,则猜想Ⅲ成立。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种化合物,分别由K+、Ba2+、SO42—、CO32、OH—中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D的化学式。
A、________,B、________,C、________,D、________。
(2)写出下列反应的离子方程式。
B与盐酸反应:_______________________________________________,
C与硫酸反应:_______________________________________________,
E(少量)与澄清石灰水反应:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去乙酸乙酯中残留的乙酸,有效的处理方法是( )
A. 蒸馏 B. 水洗后分液
C. 用过量饱和碳酸钠溶液洗涤后分液 D. 用过量氯化钠溶液洗涤后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定

实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
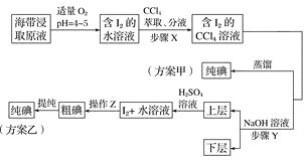
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.配制0.5 L 10 mol·L-1的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g· cm-3)与10 mL 18.4 mol·L-1硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
①溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
②工业合成氨反应N2(g) +3H2(g)![]() 2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
③反应2 NO2(g) ![]() N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
④对于2HI(g) ![]() H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,0.5mol N2和1mol O2 的混合气体的体积约是_____.
(2)标准状况下,气体的摩尔体积是______,0.5mol CO2 的质量是____,在标准状况下的体积是_____.
(3)①标准状况下,2mol NH3与 _______g CO2的体积相等.
②等质量的O2和O3所含的原子个数之比是______.
③用金属Na、Mg、Al与足量的稀盐酸反应,欲制取相同条件下等体积的H2,则需要金属Na、Mg、Al的质量比为_____(最简整数比).
④已知14g A和40g B恰好完全反应生成0.25mol C和38g D,则C的相对分子质量为__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 CO2 在一定条件下与 H2 反应转化为甲醇(CH3OH)是变废为宝的好办法,一定条件下,每转化 44 kg CO2 放出的热量为 49000 kJ,CO2 转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是

A. 0~3 min 内,用 CO2 和 H2 来表达的平均反应速率相等,均为 0.5 mol/(L·min)
B. 此反应的热化学方程式为 CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H = - 49 kJ/mol
C. 此条件下反应的平衡常数K=0.753×1.25/(0.75×0.75)
D. 降低温度,此反应的平衡常数可能为 0.8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com