
已知反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
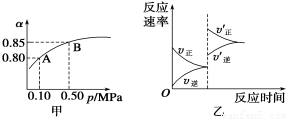
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
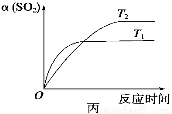
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
科目:高中化学 来源:2016届湖北省师大一附高三5月月考理综化学试卷(解析版) 题型:填空题
利用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。一种处理铅酸蓄电池的流程如下:

已知。Ksp(PbSO4)=1.6×10 -8) 和Ksp(PbCO3)=1.4×10-14
(1)写出铅酸蓄电池放电时的总反应: __________。
(2)废旧电池的预处理时需要将电池放电完全,目的是__________。
(3)写出铅膏脱硫时的离子方程式__________。
(4)传统的铅蓄电池的处理工艺是将电池破碎后,洗涤,干燥,直接送入回转炉熔炼。而该工艺使用纯碱脱硫的显著优点是__________。
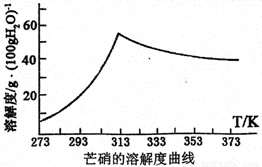
(5)已知芒硝(Na2SO4·10H2O)的溶解度曲线如下图所示,则从Na2SO4溶液中结晶出Na2SO4晶体的方法是加热结晶、__________、用乙醇洗涤晶体。用乙醇不用水洗涤的原因是__________。
(6)应用电化学原理,将铅膏转化为铅可以非常清洁处理蓄电池,其原理是先用细菌将铅膏转换为PbS,再用氟硼酸铁浸出PbS,化学方程式为:
PbS+2Fe[BF4]3=Pb[BF4]2+2Fe[BF4]2+S
最后通过电解浸出液得到金属铅,电解后的溶液可以循环使用,写出电解的总反应方程式__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期中化学试卷(解析版) 题型:填空题
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)与NH3互为等电子体的分子、离子有________、________(各举一例)。
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为________;若此离子与[Cu(H2O)4]2+结构相似,则此离子的空间构型为 。
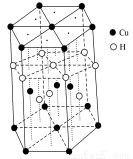
(3)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为________。
(4) 甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内的O-C-H键角________(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角;甲醇易溶于水的原因是 。
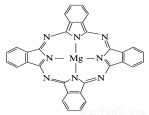
(5) 金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如图所示,其中N原子的杂化方式为 ,在如图的方框内请在图中用箭头表示出配位键。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期中化学试卷(解析版) 题型:选择题
通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为: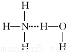
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:填空题
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下面是八种短周期元素的相关信息(已知铍的原子半径为0.089 nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色。
(1)C元素在元素周期表中的位置 。B形成的简单离子的结构示意图 。
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。
(3)用电子式表示A、D形成化合物的过程: 。
(4)H、E形成原子个数比为1∶1的化合物中所含化学键类型为 。
(5)GE2的电子式为 ,F与G形成的最简单的化合物的结构式为 。
(6)E的氢化物比C的氢化物的熔沸点高的原因是 。
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示) 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
下列变化不能用勒夏特列原理解释的是( )
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.工业合成氨的反应,往往需要使用催化剂
C.Fe(SCN)3溶液中加入少量固体KSCN后颜色变深
D.实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
A.反应混合物的浓度 B.反应体系的压强
C.正、逆反应的速率 D.反应物的转化率
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下第一次月考化学试卷(解析版) 题型:选择题
下表是A、B、C、D、E、F六种前20号元素的部分化合价、电负性和原子半径数据。下列说法正确的是( )
A | B | C | D | E | F | |
化合价 | +1 | -2 | -1 | -2 | -1 | +2 |
电负性 | 2.1 | 2.5 | 3.0 | 3.5 | 4.0 | 1.0 |
原子半径/nm | 0.037 | 0.102 | 0.099 | 0.073 | 0.071 | 0.194 |
A.A的单质中含有金属键 B.FD2含有非极性共价键
C.沸点:A2D<A2B D.最高价氧化物对应水化物的酸性:B>C
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
现有aXm+和bYn—两种离子,它们的电子层结构相同,则a的值是
A.b+m+n B.b+m-n C.b-m+n D.b-m-n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com