
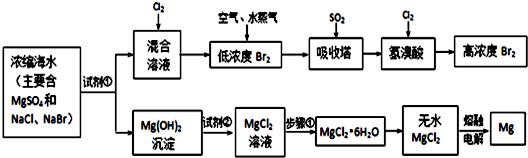
分析 浓缩海水中主要含MgSO4、NaCl、NaBr,加入试剂氢氧化钙或氢氧化钠沉淀镁离子,过滤得到混合溶液中通入氯气,得到低浓度的溴单质,进入吸收塔用二氧化吸收得到溴化氢,再通入氯气得到高浓度的溴单质,氢氧化镁沉淀中加入氢氧化钠溶液溶解得到氯化镁溶液,加热、蒸发、冷却、结晶、过滤得到氯化镁晶体,在氯化氢气流中加热失去结晶水得到氯化镁固体,电解熔融氯化镁得到镁和氯气,
I.(1)根据氯气的性质书写,氯气氧化溴离子为溴单质;
(2)根据溴和二氧化硫的性质和氧化还原反应分析,二氧化硫被溴单质氧化为硫酸;
II.(1)根据制取氢氧化镁的反应分析,加入氢氧化钙溶液可以沉淀镁离子;
(2)可根据氢氧化镁和氯化镁的转化分析,加入盐酸溶解氢氧化镁生成氯化镁和水;
(3)从分离固体和溶液的方法分析,固体和液体分离用过滤;
(4)电解熔融氯化镁生成镁和氯气;
III.(1)根据含水结晶物和镁离子水解分析,镁离子水解生成氢氧化镁;
(2)根据化学方程式和pH的计算分析,得到的盐酸的质量是1.19g/cm3×168mL═199.92g.根据MgCl2•6H2O$\frac{\underline{\;523°C\;}}{\;}$ MgO+2 HCl↑+5H2O↑可知,1molMgCl2•6H2O分解可得2mol氯化氢、5mol水,二者的质量共73g+90g=163g,则需要加水:199.92g-163g=36.92g,即需要加水36.9g,浓度c=$\frac{n}{V}$;
解答 解:I.(1)浓缩溴水与试剂①反应得到氢氧化镁,剩余混合液中含有的是溴离子,通入氯气后,氯气与溴离子反应生成单质溴和溴离子,其离子方程式是Cl2+2Br-═2 Cl-+Br2.
故答案为:Cl2+2Br-═2 Cl-+Br2;
(2)单质溴经过空气吹出法后被富集在吸收塔,通入的二氧化硫与单质溴反应生成硫酸和氢溴酸,其化学方程式是:Br2+SO2+2H2O═2H2SO4+2HBr,即其离子方程式为Br2+SO2+2H2O═4H++SO42-+2 Br-.在氧化还原反应中氧化剂的氧化性比氧化产物的氧化性强,根据Cl2+2Br-═2 Cl-+Br2得,氧化性Cl2>Br2.根据得Br2+SO2+2H2O═4H++SO42-+2 Br-,氧化性Br2>S O2.即氧化性为Cl2>Br2>SO2.
故答案为:Br2+SO2+2H2O═4H++SO42-+2 Br-;
II.(1)浓缩溴水与试剂①反应得到氢氧化镁,则试剂①可以是氢氧化钠或氢氧化钙,故答案为:NaOH或Ca(OH)2;
(2)氢氧化镁与试剂②反应得到氯化镁,则试剂②必是盐酸,反应的化学方程式是Mg(OH)2+2 HCl═MgCl2+2 H2O,其离子方程式是Mg(OH)2+2 H+═Mg2++2H2O,
故答案为:Mg(OH)2+2 H+═Mg2++2H2O;
(3)要从氯化镁溶液得到含结晶水的氯化镁,就需要蒸发、冷却、结晶,并通过过滤把固体从溶液中分离出来,故答案为:过滤;
(4)电解熔融状态的无水氯化镁可以得到氯气和镁单质,即MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
III.(1)根据题意MgCl2•6H2O在523℃以上分解,实际上是MgCl2•6H2O高温失水形成氯化镁溶液,氯化镁水解生成氢氧化镁和氯化氢,然后氢氧化镁高温下分解得到氧化镁,即MgCl2•6H2O在523℃以上分解得到的应该是氧化镁、氯化氢和水,其化学方程式是MgCl2•6H2O$\frac{\underline{\;523°C\;}}{\;}$ MgO+2 HCl↑+5H2O↑,
故答案为:MgCl2•6H2O$\frac{\underline{\;523°C\;}}{\;}$ MgO+2 HCl↑+5H2O↑;
(2)得到的盐酸的质量是1.19g/cm3×168mL═199.92g.根据MgCl2•6H2O$\frac{\underline{\;523°C\;}}{\;}$ MgO+2 HCl↑+5H2O↑可知,1molMgCl2•6H2O分解可得2mol氯化氢、5mol水,二者的质量共73g+90g=163g,则需要加水:199.92g-163g=36.92g,即需要加水36.9g.
因为该盐酸中含有2molHCl,体积为0.168L,则c(HCl)═$\frac{2mol}{0.168L}$=11.9mol/L,即该盐酸中溶质的物质的量浓度是11.9mol/L.
故答案为:36.9 g;11.9.
点评 本题是从海水提炼金属镁和单质溴以及有关计算的综合题目,需要学生调用扎实的基础知识,灵活解决问题,具有一定的难度.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 淀粉通过下列转化可以得到多种有机物
淀粉通过下列转化可以得到多种有机物查看答案和解析>>
科目:高中化学 来源: 题型:解答题
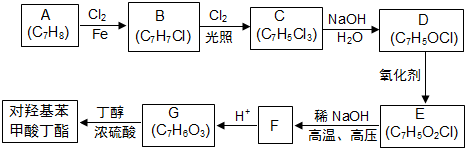
 ; F的分子式为C7H4O3Na2;
; F的分子式为C7H4O3Na2; ,该反应类型为取代反应;
,该反应类型为取代反应;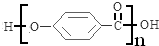 .
.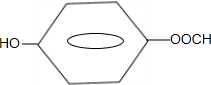 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| A | 在两份同浓度同体积的H2O2溶液中,分别加2滴FeCl3溶液和2滴CuCl2溶液,前者放在热水中,后者放在冰水中.观察气泡快慢; | 验证温度对化学反应速率的影响. |
| B | 碘化钾溶液滴到土豆片上 | 证明淀粉遇碘变蓝 |
| C | 盐酸加入碳酸钠溶液中产生CO2 | 证明氯的非金属性比碳强 |
| D | 取规格相同的绿豆大的钠分别加入到水和乙醇中 | 证明乙醇羟基中氢原子不如水分子中氢原子活泼 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2gO3和2 gO2 | B. | 9克H2O和0.5NA个CO2 | ||
| C. | 标准状况下1molO2和22.4LH2O | D. | 0.2molH2和4.48LHCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ①③④⑤⑥ | D. | .全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
“低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | tm |
| III | 900 | 2 | 4 | y | y | tn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com