
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A、平衡常数K:容器Ⅱ>容器Ⅲ | ||
| B、反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ | ||
C、反应到达平衡时,容器I中的平均速率为v(PCl5)=
| ||
| D、起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
| ||||
|
| 1 |
| 30 |
| ||||
|
| ||
| t1s |
| ||||
|
| ||||
|


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | ||
| Y | Z |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp[CaSO4] |
| B、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| C、已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 |
| D、已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水,测得混合液的pH=11,则溶液中的c(Mg2+)为1.8×10-3mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 3-n |
| 2 |
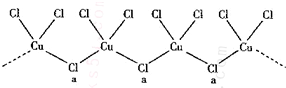
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com