
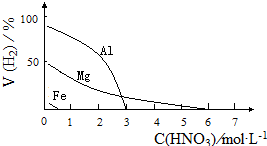
 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:| 影响因素 | 实验步骤 | 实验结论 |
| 金属种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入 | 在该浓度的稀HNO3中,Mg能反应, |
| HNO3浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入 | 硝酸浓度 |


科目:高中化学 来源: 题型:
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:| 一定条件 |
| H2 |
| Ni,△ |
| 浓H2So4 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2为0.3mol/L |
| B、Y为0.65mol/L |
| C、Y2为0.2mol/L |
| D、Z为0.7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
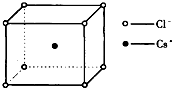 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cl-离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cl-离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4、H2SO4、HNO3 |
| B、Na2SO4、Ba(OH)2、CuCl2 |
| C、FeCl3、NaOH、KNO3 |
| D、K2SO4、NaOH、NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com