
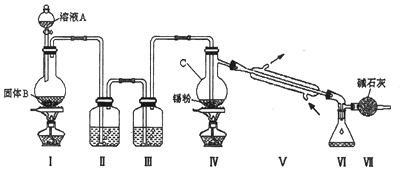
分析 由装置图可知装置Ⅰ应为制备氯气装置,涉及离子反应为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,装置Ⅱ为饱和食盐水,装置Ⅲ为浓硫酸,氯气经除杂,干燥后与锡在装置Ⅳ中反应生成SnCl4,经冷却后在装置Ⅵ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅵ中,
(1)认识常见的化学实验仪器;
(2)A为制备氯气装置,在加热条件下进行,应为浓盐酸和二氧化锰的反应
(3)B为饱和食盐水,C为浓硫酸,氯气经除杂,干燥后与锡在D中反应生成SnCl4,因SnCl4极易水解,F可起到防止空气中的水蒸气进入E中;
(4)在Ⅳ中除生成SnCl4外,还会生成SnCl4水解产生的含锡的化合物;
(5)加热促进SnCl4气化,便于分离;
(6)Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,11.9gSn即0.1mol完全反应可生成SnCl426.1g,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:由装置图可知装置Ⅰ应为制备氯气装置,涉及离子反应为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,装置Ⅱ为饱和食盐水,装置Ⅲ为浓硫酸,氯气经除杂,干燥后与锡在装置Ⅳ中反应生成SnCl4,经冷却后在装置Ⅵ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅵ中.
(1)仪器C的名称为蒸馏烧瓶,故答案为:蒸馏烧瓶;
(2)装置Ⅰ中浓盐酸与MnO2在加热时发生反应产生氯气.发生反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)由于盐酸有挥发性,所以在制取的氯气中含有杂质HCl,在与金属锡反应前要除去,因此装置Ⅱ中的最佳试剂为除去HCl同时还可以减少氯气消耗的饱和食盐水;SnCl4极易水解,在潮湿的空气中发烟.为了防止盐水解,所以要防止起水解.装置Ⅶ的作用为防止空气中的水蒸气进入Ⅵ中使SnCl4水解,
故答案为:饱和氯化钠溶液;防止空气中水蒸气进入Ⅵ中,SnCl4水解;
(4)若装置连接顺序为Ⅰ-Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4外,在Ⅳ中除生成SnCl4外,还会生成SnCl4水解产生的含锡的化合物Sn(OH)4或SnO2,还会生成的含锡的化合物的化学式为 H2SnO3 (或SnO2,或Sn(OH)4 或 H4SnO4,
故答案为:H2SnO3;或SnO2,或Sn(OH)4 或 H4SnO4;
(5)四氯化锡是无色液体,熔点-33℃,沸点114℃.Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为加热促使SnCl4气化,使SnCl4从反应混合物中分离出去,
故答案为:加热促使SnCl4气化,使SnCl4从反应混合物中分离出去;
(6)若Ⅳ中用去锡粉11.9g,则n(Sn)=0.1mol,理论上产生的SnCl4的物质的质量是m(SnCl4)=0.1mol×261g/mol=26.1g,所以反应后,若Ⅵ中锥形瓶里收集到23.8gSnCl4,则SnCl4的产率为$\frac{23.8g}{26.1g}$×100%=91.2%,
故答案为:91.2%.
点评 本题考查物质的制备,涉及仪器的识别、氯气的实验室制取方法、实验操作的目的、盐的水解、物质产率的计算等知识,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质设计实验步骤,题目难度中等.


科目:高中化学 来源: 题型:实验题
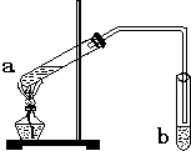 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制备,其中a中加乙醇、乙酸和浓硫酸,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制备,其中a中加乙醇、乙酸和浓硫酸,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +1940 kJ•mol-1 | B. | -1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | +485 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验中,乙烯的用量不会影响该反应的反应焓变△H | |
| B. | 0.5 mol H2O(l) 完全反应放出的热量为22.9 kJ | |
| C. | 1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和 | |
| D. | 1 mol C2H4(g)和1 mol H2O (g)中化学键的总键能大于1 mol C2H5OH(g)中化学键的总键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 化学反应中的能量变化,通常表现为热量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨中含有H2O,NH3•H2O,NH3,NH4+,NH2-等微粒 | |
| B. | 液氨中c(NH4+)•c(NH2-)是一个随温度升高而减小的常数 | |
| C. | 液氨的电离达到平衡时c(NH3)=c(NH4+)=c(NH2-) | |
| D. | 任何温度下,只要不加入其他物质,液氨中c(NH4+)和c(NH2-)一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com