
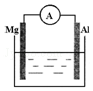
 如图所示装置中,金属镁、铝和电流表通过导线相连:
如图所示装置中,金属镁、铝和电流表通过导线相连:分析 根据自发的氧化还原反应能设计成原电池,失电子的一极是负极,得到电子的是正极,结合电极上反应物分析.
解答 解:(1)镁、铝和稀硫酸构成了原电池,金属镁做负极,电极反应:Mg-2e-=Mg2+,金属铝为正极,溶液中的2H+得到电子发生还原反应,电极反应为:2H++2e-=H2↑;
故答案为:Mg-2e-=Mg2+;2H++2e-=H2↑.
(2)镁、铝和NaOH溶液构成了原电池,铝易失电子作负极,电极反应式为Al+4OH--3e-=AlO2-+2H2O,正极上水得电子发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-,
故答案为:Al+4OH--3e-=AlO2-+2H2O;2H2O+2e-=H2↑+2OH-.
点评 本题考查了原电池原理,正确判断原电池正负极是解本题关键,根据各个电极上发生的反应以及电解质溶液分析解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
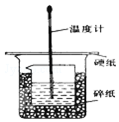 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温州 t1/℃ | 终止温度(t2)/℃[ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得某HA溶液中c(HA)=0.01mol•L-1 | |
| B. | 碳酸钠溶液中滴入0.1mol•L-1的HA溶液,产生大量无色气体 | |
| C. | 室温下测得某HA溶液的pH=a,用蒸馏水稀释100倍测得溶液pH=b,且b-a<2 | |
| D. | 室温下,测得0.1mol•L-1HA溶液的pH>1,证明HA是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ① | ② | ③ | ④ | ⑤ |
| 物质所含的微粒数 | 固体体积 | 溶液的质量百分比浓度 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式为Na:$\underset{\stackrel{•}{C}}{•}\underset{\stackrel{•}{l}}{•}$: | |
| B. | 次氯酸的电子式H:$\underset{\stackrel{•}{C}}{•}\underset{\stackrel{•}{l}}{•}$: | |
| C. | 二氧化碳的结构式为O=C=O | |
| D. | NaHCO3的电离方程式为NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com