
| ������ | V��0.20mol/H2 | V������ˮ��/mL | V��0.010mol/L KMnO4��Һ��/mL | T/�� | �� |
| �� | 2.0 | 0 | 4.0 | 50 | |
| �� | 2.0 | 0 | 4.0 | 25 | |
| �� | 1.0 | a | 4.0 | 25 |
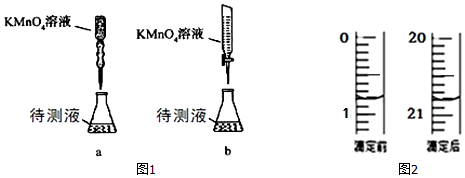
���� ��1����̽��ijһ�����ضԷ�Ӧ���ʵ�Ӱ��ʱ�����뱣������Ӱ������һ�£�Ҫ̽��H2C2O4��ҺŨ�Ȳ�ͬ�Է�Ӧ���ʵ�Ӱ�죬������H2C2O4��Һ�������ͬ������Ӧ�����Һ�����������ͬ����Ӧ��������ˮ��ȷ����Һ���������Ϊ6mL��Ҫȷ������Ӧ���ʵĿ���������ȷ�����Һ��ɫʱ��ij��̣�
��2��H2C2O4��Һ������KMnO4��Һ��Ӧ���ɶ�����̼�������Ӻ�ˮ��
��3���ݸ�����س����ԣ�ʢ������ʽ�ζ�������ѡ��
��4�����ݵζ��ܵĽṹ����ȷ���Լ�����ԭ�������
��5���ݵζ��յ���ж�����Һ����ɫ�ı仯��������
��6���ݴ�6H++5H2C2O4+2MnO4-=2Mn2++10CO2��+8H2O���ӷ���ʽ�����㣻�ݵζ��������۾�Ӧע����Һ����ɫ�仯�����жϵζ��յ���������� c�����⣩=$\frac{c��������v������}{v�����⣩}$��������������V��������Ӱ�죬�Դ��ж�Ũ�ȵ���
��� �⣺��1����̽��ijһ�����ضԷ�Ӧ���ʵ�Ӱ��ʱ�����뱣������Ӱ������һ�£�ͨ���Ƚ�ʵ��٢ڵķ�Ӧ������֪��ʵ��٢ڿ�̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻ʵ��ڢ��е�H2C2O4��Һ�ļ��������ͬ����Ҫ̽��H2C2O4��ҺŨ�Ȳ�ͬ�Է�Ӧ���ʵ�Ӱ�죬����Ӧ�����Һ�����������ͬ����Ӧ��������ˮ��ȷ����Һ���������Ϊ6.0mL����a��ֵΪ1.0��Ҫȷ������Ӧ���ʵĿ���������ȷ�����Һ��ɫʱ��ij��̣�����Ҫ����������������Һ��ɫ��ʱ�䣨t��Һ��ɫʱ��/s����
�ʴ�Ϊ���¶ȣ�1.0��t��Һ��ɫʱ��/s
��2��H2C2O4��Һ������KMnO4��Һ��Ӧ���ɶ�����̼�������Ӻ�ˮ���䷴Ӧ�����ӷ���ʽΪ��6H++5H2C2O4+2MnO4-=2Mn2++10CO2��+8H2O��
��3�����������Һ�����ԣ�Ӧʢ������ʽ�ζ����У��ʴ�Ϊ��b
��4������A����������ʽ�ζ��ܣ��ζ��ܵζ�ǰ�����Ϊ��0.80mL��20.80mL������KMnO4��Һ���Ϊ20.80mL-0.80mL=20.00mL���ʴ�Ϊ��20.00mL
��5��������KMnO4��ҺΪ�Ϻ�ɫ���ζ��յ�ʱ��ɫ��Ϊ�Ϻ�ɫ���Ұ���Ӳ���ɫΪ�ζ����յ���۾�Ӧע����Һ����ɫ�仯���ʴ�Ϊ����ƿ����ɫ��ɫ
��6��6H++5H2C2O4+2MnO4-=2Mn2++10CO2��+8H2O
5 2
n=0.0025 0.02��0.05
m��H2C2O4��=0.0025��90=0.225g�� m��H2C2O4•xH2O ��=1.26��$\frac{25}{100}$=0.315g�� m��H2O��=0.315-0.225=0.09g��n��H2O��=$\frac{0.09}{18}$=0.005mol��
����Ϊ n H2C2O4��=0.0025 mol ����Ԫ���غ㼴n��H2C2O4•xH2O ��=0.0025mol��n��H2O��=0.0025x��
�����٢ڵ�0.005=0.0025x���x=2��
δ�ñ�KMnO4��Һ��ϴ�ζ��ܣ���Һ��ϡ�ͣ����V������ƫ���� c�����⣩=$\frac{c��������v������}{v�����⣩}$��c�����⣩ƫ�ʴ�Ϊ��2��ƫ��
���� ���⿼��������ĵ��뷽��ʽ��д��������ԭ��Ӧ����ʽ��д�Լ�Ӱ�컯ѧ��Ӧ�������ص�ʵ��̽��������Ӱ�췴Ӧ���ʵ����ص�̽����Ӧע����ǵ�̽��ijһ�����ضԷ�Ӧ���ʵ�Ӱ��ʱ�����뱣������Ӱ������һ�£��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D |
 |  |  |  |
| �����շ��ɼ���ë���������α | ��īд�ֻ����ɳ��ò���ɫ | ֽ����ֽԭ�ϵ���Ҫ�ɷ־�����ά�� | ��ʯ��������̨�Ĺ����ǻ�ѧ�仯 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ӱ���ģ�ͣ� | |
| B�� | ԭ�Ӻ�����18�����ӵ�ԭ�ӣ�${\;}_{17}^{35}$Cl | |
| C�� | 1��2-��������Ľṹ��ʽ��C2H4Br2 | |
| D�� | �����������ʽ��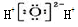 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 16��25 | B�� | 1��7 | C�� | 1��6 | D�� | 2��11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ���¶��£���0.1mol/L�Ĵ����еμ���ͬŨ�ȵİ�ˮ��$\frac{c��N{H}_{4}^{+}��}{c��N{H}_{3}•{H}_{2}O��}$һֱ��С | |
| B�� | ��֪Ksp��BaSO4��=1.07��10-30��Ksp��BaCO3��=2.58��10-9�����Բ��ܽ�BaSO4ת��ΪBaCO3 | |
| C�� | ��������Һ�ζ�ǿ����Һʱ���ü�����ָʾ�� | |
| D�� | ��֪���볣��HCN��Ka=4.9��10-10��H2CO3��Ka1=4.3��10-7��Ka2=5.6��10-11����KCN��Һ��ͨ������CO2ʱ�����ӷ���ʽΪ2CN-+H2O+CO2�T2HCN+CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪ 0.2 mol•L-1��NaHSO3��Һ��pH��7������Һ��һ���У�c��H2SO3����c��SO32-�� | |
| B�� | 0.02 mol/L��NaOH��Һ��0.02 mol/L��NaHC2O4��Һ��������Һ��2c��OH-��+c��C2O42-��=c��HC2O4-��+2c��H+�� | |
| C�� | ��ˮ����ε�����������Һ��pH=7������Һ��c��NH4+��=c��Cl-�� | |
| D�� | �����ᣨHN3����������������0.1 mol•L-1NaN3ˮ��Һ������Ũ�ȴ�С˳��Ϊ��c��Na+����c��N3-����c��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com