
| A. | B2A2和B2A中阴阳离子的个数比相同 | |
| B. | 原子半径的大小顺序:r(D)>r(C)>r(B)>r(A) | |
| C. | D的简单气态氢化物的热稳定性比A的强 | |
| D. | 元素C的单质是一种高硬度、高熔点的金属 |
分析 短周期元素A、B、C、D的原子序数依次增大,B+与A2-具有相同的电子层结构,则A为O元素,B为Na元素;A与D同主族,则D为S元素;C原子的最外层电子数等于A原子最外层电子数的一半,则C原子最外层电子数为3,故C为Al元素,据此解答.
解答 解:短周期元素A、B、C、D的原子序数依次增大,B+与A2-具有相同的电子层结构,则A为O元素,B为Na元素;A与D同主族,则D为S元素;C原子的最外层电子数等于A原子最外层电子数的一半,则C原子最外层电子数为3,故C为Al元素.
A.Na2O2和Na2O中阴阳离子的个数比均为1:2,故A正确;
B.同一周期从左到右半径原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>S>O,故B错误;
C.非金属性A(O)>D(S),故氢化物稳定性A>D,故C错误;
D.Al元素单质,硬度小、熔点不是很高,故D错误,
故选:A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,离子电子层结构相同为推断突破口,注意抓住短周期元素,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 如图为向100mL 2mol/L AlCl3溶液中加入2mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:
如图为向100mL 2mol/L AlCl3溶液中加入2mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | ||
| A | X | C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
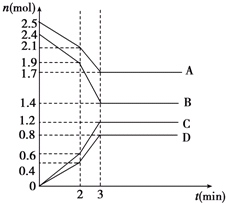 在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题:
在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律(或性质) | 结 论 |
| A | 主族元素最高正化合价等于族序数 | 第VⅡA族元素最高正价都是+7 |
| B | SO2和湿润的Cl2都有漂白性 | 二者混合后漂白性更强 |
| C | 常湿下铜与浓硝酸反应可以制取NO2 | 常温下铁与浓硝酸反应也可以制取NO2 |
| D | 较强酸可以制取较弱酸 | CO2通入NaClO溶液液中能生成HC10 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱、Na2O2、NH4NO3、Ca(OH)2均为离子化合物 | |
| B. | HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 | |
| C. | 经分析某物质只含有一种元素,则该物质一定是纯净物 | |
| D. | 金属氧化物一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
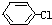 +NaOH→
+NaOH→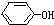 +NaCl,该反应的反应类型属于( )
+NaCl,该反应的反应类型属于( )| A. | 加成反应 | B. | 取代反应 | C. | 氧化还原反应 | D. | 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| B. | PM 2.5亦称可入肺颗粒物,分散在空气中形成胶体,能吸附有毒有害物$\frac{2b}{a-2b}$质 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| D. | 绚丽缤纷的烟花中添加了含钾、钠、钙、钡等金属元素的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com