
分析 (1)依据溶液稀释过程中溶质的物质的量不变,计算需要溶液体积,依据溶液体积选择量筒规格;
(2)根据配制一定物质的量浓度溶液的实验步骤选择使用的仪器和缺少的仪器;
(3)根据配制一定物质的量浓度溶液的实验步骤排序;
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析判断.
解答 解:(1)用18.4mol/L的浓硫酸配制lmol/L稀硫酸100mL,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=1mol/L×100mL
,解得V=5.4mL;依据“大而近”原则,应选择10mL量筒;
故答案为:5.4mL; 10;
(2)所需的基本仪器可由实验步骤得出:量筒、烧杯、玻璃棒、100 mL容量瓶、胶头滴管,配制时,还缺少的仪器是100mL容量瓶、胶头滴管;
故答案为:100mL容量瓶;胶头滴管;
(3)溶用浓溶液配制稀溶液的一般步骤为:计算-量取-稀释-移液-洗涤-定容-摇匀-装瓶,所以正确的顺序为:①④③②⑤;
故答案为:①④③②⑤;
(4)定容时,如果俯视刻度线,导致溶液的体积偏小,溶液浓度偏大;
故答案为:偏大.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,明确配制原理及操作步骤是解题关键,注意容量瓶、量筒规格的选择,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 77 | B. | 95 | C. | 172 | D. | 249 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,氧气发生氧化反应 | |
| B. | 电池正极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电池负极的电极反应为:2C8H18+50 O2-═16CO2+18H2O+100 e- | |
| D. | 若消耗的O2为11.2 L (标准状况),则电池中有1 mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
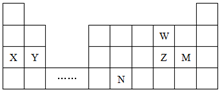
| A. | 原子半径:Y>Z>W | |
| B. | 单质的还原性:X>Y | |
| C. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 | |
| D. | 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al | |
| B. | 可以用铝热反应来制取镁 | |
| C. | 铁在高温下与水蒸气反应生成Fe2O3和H2 | |
| D. | Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓盐酸 | B. | Na2SO4浓溶液 | C. | NaOH浓溶液 | D. | Ba(OH)2浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
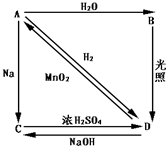 常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示
常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中金属钠通常保存在煤油里 | |
| B. | 液溴易挥发,在存放液溴的试剂瓶中应加水封 | |
| C. | 保存FeCl3溶液时,通常在溶液中加少量的单质铁 | |
| D. | 浓硝酸通常保存在棕色试剂瓶中,置于阴凉处 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com